
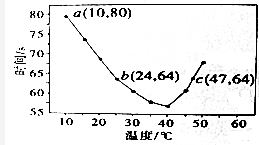
 NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )
NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )| A. | a点的溶液中:c(SO42-)>c(NH4+)>c(H+)>c(Na+)>c(OH-) | |
| B. | b点的溶液中:c(Na+)=c(SO42-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | c点的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | d、e点对应溶液中,水电离程度大小关系是d>e |
分析 A.a点的溶液中,100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液为20mL,NH4HSO4过量;
B.b点NaOH为100mL,NH4HSO4与NaOH等物质的量反应生成等浓度的(NH4)2SO4和Na2SO4,溶液显弱酸性;
C.c点的溶液pH=7,NaOH稍微过量,溶液中c(OH-)=c(H+);
D.d、e点对应溶液中,氨水过量,溶液显碱性,氨水电离的氢氧根离子抑制了水的电离,氢氧根离子浓度越大,水的电离程度越小.
解答 解:A.a点的溶液中,100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液为20mL,NH4HSO4过量,剩余的NH4HSO4大约是Na+的4倍,已知NH4HSO4=NH4++H++SO42-,所以c(SO42-)>c(NH4+)>c(H+)>c(Na+)>c(OH-),故A正确;
B.b点NaOH为100mL,NH4HSO4与NaOH等物质的量反应生成等浓度的(NH4)2SO4和Na2SO4,溶液显弱酸性,由于Na+、SO42-都不水解,所以c(Na+)=c(SO42-),NH4+水解显酸性,水解程度较小,所以c(NH4+)>c(H+),则溶液中离子浓度关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.c点的溶液pH=7,NaOH稍微过量,则c(Na+)>c(SO42-),溶液中c(OH-)=c(H+),所以溶液中离子浓度关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故C正确;
D.d、e点对应溶液中,氨水过量,溶液显碱性,氨水电离的氢氧根离子抑制了水的电离,氢氧根离子浓度越大,水的电离程度越小,由图可知,e点溶液中氢氧根离子浓度大,则水的电离程度小,即水电离程度大小关系是d>e,故D正确.
故选B.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较等知识,题目难度中等,明确酸碱混合的定性判断及溶液酸碱性与溶液pH的计算方法为解答关键,试题侧重考查学生的分析、理解能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Cl>I | B. | 碱性:KOH>NaOH | ||
| C. | 酸性:H2SO3>H2SO4 | D. | 结合H+能力:CO32->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中可能有固体残渣 | B. | 所得溶液中存在Fe2+、Fe3+、Cu2+ | ||
| C. | 原固体中n(Fe2O3)>n(Cu) | D. | 再加入铜后,溶液红色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性 HCl>H2SO3 | B. | 金属性 Mg>Al | C. | 碱性 NaOH>Mg(OH)2 | D. | 稳定性 HF>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木糖醇( 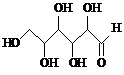 )和葡萄糖( )和葡萄糖(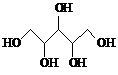 )互为同系物,均 )互为同系物,均属于糖类 | |
| B. | 分子式为C6H14的有机物其一氯代物有三种,此有机物可能是3,3-二甲基丁烷 | |
| C. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 | |
| D. | 等质量的乙烯、甲醚、碳酸二甲酯(CH3OCOOCH3)完全燃烧耗氧量一定不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
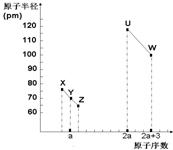 X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是( )
X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是( )| A. | U、X、W 三种元素最高价氧化物的水化物酸性依次增强 | |
| B. | 由Y、Z和氢三种元素形成的化合物中只有共价键 | |
| C. | XZ2、YZ2与X60的化学键类型和晶体类型都相同 | |
| D. | T元素与U同主族且在下一周期,能形成化合物TW4、TZ2、T3Y4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32─):n(HSO3─) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
| c(H+)/mol•L─1 | 6.3×10─9 | 6.3×10─8 | 6.3×10─7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液, | 前者溶液变蓝, 后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液 褪色 | 一定产生了乙烯 |
| D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液 | 溶液褪色 | CaCl2溶液有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com