
用1L1.0mol.L-1NaOH溶液吸收0.6molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比为
A.1:3 B.1:2 C. 2:1 D.3:2
2:1 D.3:2
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+ B.Al(OH)3 C.AlO2- D.Al3+和Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末化学卷(解析版) 题型:推断题
(1)X是最简单的烯烃。现有如下的反应关系:(已知F是一种常见的塑料)
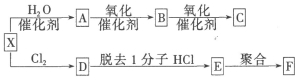
①X的结构简式为 ;C的官能团名称是 。
②由E制取F的化学方程式为 。
(2)某实验小组用下列装置进行A转化为B的实验。
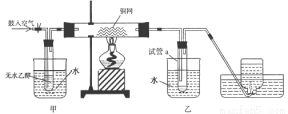
①请写出A制取B的化学反应方程式:___________________________。
②甲和乙两个水浴作用不相同。甲的作用是_____________;乙的作用是_____________。
③试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,要除去该物质,可在混合液中加入___(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
(3)阿斯匹林的结构简式为: ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为 。
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为 。
(4)某烃的分子式为C8H10,其不能使溴水褪色,但可使酸性KMnO4溶液褪色,且此烃与液溴在催化剂条件下只得到一种取代产物,其结构可能有 种。
A.1种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省孝义市高一下学期升级考试化学试卷(解析版) 题型:填空题
为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取ag样品,向其中加入足量的NaOH溶液,测得生成气体的体积(标准状况,下同)为b L 。反应的离子方程式为 。样品中铝的质量为 g。
(2)若使ag样品恰好完全反应,则反应中氧化铁与铝的质量比是 ,化学方程式为 。
(3)待(2)中生成物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与(1)中所得气体的体积比c:b = 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省孝义市高一下学期升级考试化学试卷(解析版) 题型:选择题
在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s) + 2B(g)  C(g) + D(g) 已达平衡状态的是
C(g) + D(g) 已达平衡状态的是
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省邵阳市高一上学期第三次月考化学试卷(解析版) 题型:选择题
天然铊有两种稳定同位素, 和
和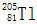 。下列有关铊的同位素说法中,不正确的是
。下列有关铊的同位素说法中,不正确的是
A. 和
和 质子数相同
质子数相同
B. 和
和 互为同素异形体
互为同素异形体
C. 和
和 中子数之差为2
中子数之差为2
D. 原子核内中子数与核外电子数之差为43
原子核内中子数与核外电子数之差为43
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上学期12月月考化学试卷(解析版) 题型:填空题
(1)CCl4和蒸馏水都是无色液体,请按下列要求用实验方法鉴别之(简要地写出实验过程)
① 只允许用一种试剂________________
② 不用任何试剂________________
(2)NaCl溶液中含有少量的CaCl2,某学生用过量的Na2CO3使Ca2+离子转化为沉淀而除去,确认Na2CO3已过量的实验方法是________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁任城区高二上学期统考化学试卷(解析版) 题型:选择题
下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是
A.增大反应物的浓度,活化分子百分数增加,反应速率加快
B.增大气体反应的压强,单位体积中活化分子数增多,气体反应速率加快
C.升高温度能使化学反应速率增大,主要原因是增加了活化分子的百分数,从而使有效碰撞频率提高
D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期末理综化学试卷(解析版) 题型:填空题
工业生产硝酸铵的流程如下图所示:
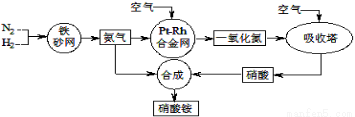
(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H < 0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H < 0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 。
A.及时分离出NH3可以提高H2的平衡转化率
B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
D.M点比N点的反应速率快
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K ≈ 0.93 L2/mol2
(3)尿素[ CO(NH2)2 ]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式: 。
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下左图所示:
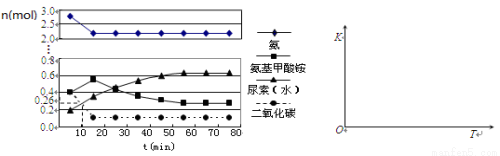
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
②在上右图中画出第二步反应的平衡常数K随温度的变化的示意图。
(5)电解尿素[ CO(NH2)2 ]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com