
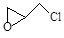 ,则该有机物核磁共振氢谱有 个峰。
,则该有机物核磁共振氢谱有 个峰。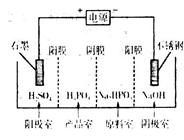



 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.是吸热反应 |
| B.是放热反应 |
| C.吸收183 kJ热量 |
| D.放出183 kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,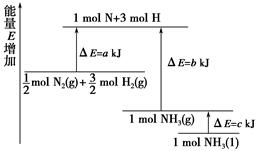
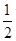 mol N2(g)和
mol N2(g)和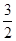 mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应物的总能量低于生成物的总能量时,一定不能自发进行反应 |
B.已知:CH4(g)+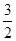 O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热 O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热 |
| C.恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)??2C(g),充分反应后测得放出的热量为Q kJ,则该反应的ΔH=-Q kJ/mol |
| D.由4P(s,红磷)=P4(s,白磷) ΔH=+139.2 kJ/mol,可知红磷比白磷稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由“C(石墨)=C(金刚石) ΔH=1.9kJ/mol”可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,若将含1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=—285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 。请回答下列问题:
。请回答下列问题:
 H2NCOONH4(l)(氨基甲酸铵) ΔH1
H2NCOONH4(l)(氨基甲酸铵) ΔH1 H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生成物总能量一定低于反应物总能量 |
| B.酒精可用作燃料,说明酒精燃烧是释放能量的反应 |
| C.干冰气化需要吸收大量的热,这个变化是吸热反应 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③⑤ | B.①②③⑦ |
| C.①②⑤⑥⑦ | D.④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
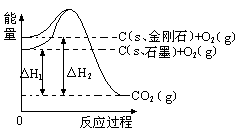
| A.石墨和金刚石的转化是物理变化 |
| B.1mol石墨的总能量比1 mol金刚石的总能量大1.9 kJ |
| C.金刚石的稳定性强于石墨 |
| D.C(s、石墨)=C(s、金刚石) △H=" +1.9" kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com