
| A、S→S03 |
| B、Al203→Al( OH)3 |
| C、Si02→H2SiO3 |
| D、Na2CO3→NaOH |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
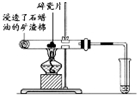 按要求完成下列问题:
按要求完成下列问题: ),根据质量守恒定律,可判断出另一个反应产物为
),根据质量守恒定律,可判断出另一个反应产物为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含4 mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| B、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| C、1 L 1mol?L-1的CH3COONa溶液中含有CH3COO-的数目为NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与水反应Cl2+H20═2H++Cl-+ClO- |
| B、将铝粉投入氧氧化钠离溶液中:2Al+20H-═2AlO2-+H2↑ |
| C、金属钠与水反应:2Na+2H20═2Na++20H-+H2↑ |
| D、氯化铝溶液与过量氨水反应Al3++4NH3?H2O═Al02-+4NH4++2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀盐酸反应:Fe+2H+═Fe2++H2↑ |
| B、碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、硫酸溶液中加入碳酸氢钠溶液:H++HCO3-═CO2↑+H2O |
| D、在氢氧化钾的稀溶液中通过量的二氧化碳气体:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫具有较强的还原性,故不能用浓硫酸干燥 |
| B、含极性键的共价化合物一定是电解质 |
| C、氯化钠、冰醋酸、酒精分别属于强电解质、弱电解质、非电解质 |
| D、天然气、酒精和液化石油气分别属于化石能源、不可再生能源和二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.1NA个乙炔分子完全燃烧需要的O2的体积约为11.2L |
| B、标准状况下,11.2L乙烯分子中含有的碳碳共用电子对数目为0.5NA |
| C、15g乙烷分子中含有的碳氢键数目为3NA |
| D、常温常压下,1 mol氦气含有的核外电子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位.工业制硝酸的主要反应之一是:| 浓度/mol?L-1 时间/min | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com