
| A. | Na2CO3 | B. | BaCl2 | C. | NaCl | D. | H2SO4 |
科目:高中化学 来源: 题型:选择题
| A. | △H1<0,△H3>0 | B. | △H1>△H4 | ||
| C. | △H4=△H2-△H1-2△H3 | D. | △H4-△H1-△H2<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “滴水石穿、绳锯木断”一定不涉及化学变化 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| C. | 充分开发利用天然纤维,停止使用各种化学合成材料 | |
| D. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液 CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水与盐酸反应:H++OH-═H2O | |
| C. | 碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NH4HSO4固体,v(H2)不变 | B. | 加入少量硫酸钠溶液,v(H2)减小 | ||
| C. | 加入CH3COONa固体,v(H2)不变 | D. | 滴加少量CuSO4溶液,v(H2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1 mol•L-1的Na2SO3溶液490mL,需用500ml容量瓶 | |
| B. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) | |
| C. | 在标准状况下,将22.4L氨气溶于1L水中,得到1mol•L-1的氨水 | |
| D. | 10mL质量分数为70%的乙醇用10mL水稀释后;乙醇的质量分数小于35% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
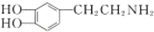 是一种重要的中枢神经传导物质,是用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受,多巴胺可由D(香兰素)与硝基甲烷反应后再经锌汞齐还原水解制得.合成过程如图所示:
是一种重要的中枢神经传导物质,是用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受,多巴胺可由D(香兰素)与硝基甲烷反应后再经锌汞齐还原水解制得.合成过程如图所示:
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$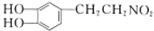 .
.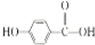 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.
(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”.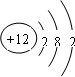 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com