
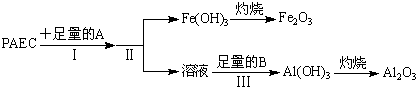
| 过量稀盐酸 |
| 试剂X |
| HCl(或NaOH) |
| 调节pH |
| 水解 |
| 聚合 |


科目:高中化学 来源: 题型:
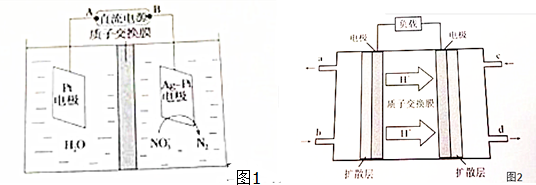
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于20mL |
| B、小于20mL |
| C、等于30mL |
| D、大于30ml. |
查看答案和解析>>
科目:高中化学 来源: 题型:
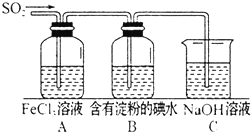 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
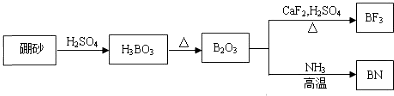
查看答案和解析>>
科目:高中化学 来源: 题型:
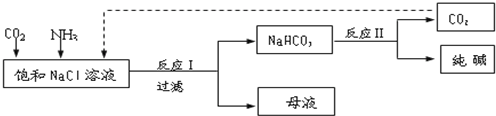
| ||
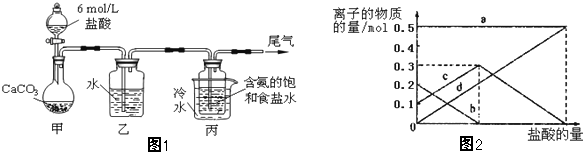
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用分液的方法分离水和汽油的混合物 |
| B、用过滤的方法分离饱和食盐水与沙子的混合物 |
| C、蒸馏时,应使温度计水银球插入液面以下 |
| D、蒸发结晶时应将溶液蒸干后再停止加热 |
| E、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl- | ||
| B、水电离出的c(H+)=1×10-13的溶液:K+、Mg2+、NO3-、Cl- | ||
C、在
| ||
| D、甲基橙显红色的溶液:Na+、CO32-、NO3-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com