
 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:| A. | 在T2时,若反应体系处于状态D,则此时v正>v逆 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB | |
| D. | 该反应的△H>0 |
分析 A.由图可知,T2时反应进行到状态D,c(CO)高于平衡浓度,故反应向逆反应进行;
B.化学平衡常数只受温度影响,升高温度平衡向吸热反应移动,根据平衡移动判断温度对平衡常数的影响分析;
C.达到平衡状态时,压强和温度成正比例关系;
D.由图可知,温度越高平衡时c(NO)越大,即升高温度平衡逆移.
解答 解:A.T2时反应进行到状态D,c(NO)高于平衡浓度,故反应向正反应进行,则一定有υ(正)>υ(逆),故A正确;
B.该反应正反应是放热反应,升高温度平衡向逆反应移动,所以升温化学平衡常数减小,故K1>K2,故B错误;
C.达到平衡状态时,压强和温度成正比例关系,则PB=PD<PC,故C错误;
D.由图可知,温度越高平衡时c(NO)越大,即升高温度平衡逆移,所以正反应为放热反应,即△H<0,故D错误;
故选A.
点评 本题以化学平衡图象为载体,考查温度对平衡移动的影响、对化学平衡常数的影响等知识,题目难度中等,注意曲线的各点都处于平衡状态,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
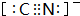 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它含有的化学键类型有AC(填序号).
,它含有的化学键类型有AC(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
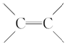 )不能自由旋转,因此
)不能自由旋转,因此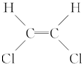 和
和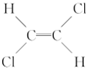 是两种不同的化合物,互为顺反异构体,则分子式为C4H7Cl的烯烃的异构体有( )
是两种不同的化合物,互为顺反异构体,则分子式为C4H7Cl的烯烃的异构体有( )| A. | 12种 | B. | 11种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于稀盐酸中:Ca2++2H+=Ca2++H2O+CO2↑ | |
| B. | 向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 铜片跟稀硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
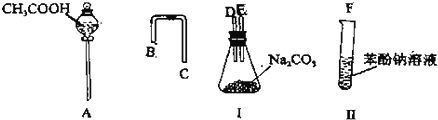
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com