
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
【答案】D
【解析】
此题考查化学用语,化学用语包括:化学式,结构式,电子式,原子结构示意图以及不同核素的表达,也属于简单题
A.考察核素的表达:abX,其中a表示X原子的相对原子质量,b表示X原子的质子数,那中子数=a-b,所以A选项表示的是中子数为1的氯原子与题意不符;B考察的结构式,因为氮原子最外层电子数为5,还需要3个电子形成8电子稳定结构,所以俩个氮原子共用3对电子因此氮气的结构式为氮氮三键的形式,故B错误;C.考察的原子结构示意图,钠原子的核外有11个电子,而钠离子是由钠原子失去一个电子形成的,那么钠离子的一共有10个电子,C选项有11个,表示的钠原子的结构示意图,故错误。D.氧原子最外层六个电子,两个氢分别和氧公用一对电子。D正确。
故选D。


科目:高中化学 来源: 题型:
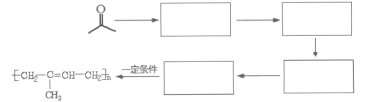
【题目】请结合下列有机物回答相关问题,

(1)有机物A习惯命名为___________,标注“*”的碳原子连接起来构成的图形为________(填“菱形”、“正方形”或“正四面体形”)。E是A的同系物,且比A少一个碳原子,则E的一氯代物有______种。
(2)相同质量的上述四种有机物完全燃烧时耗氧量最大的是_______________(填结构简式)
(3)有机物B能实现如下转化:

各步转化的反应条件为①___________________________;②__________________________。
(4)有机物D的官能团名称为_______________,D在一定条件下能生成高分子化合物的反应化学方程式为___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________。
(3)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+____(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+) _______c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是自来水表的常见安装方式。下列有关说法不正确的是

A. 该安装方式的水表更容易被腐蚀
B. 发生腐蚀过程中,电子从接头流向水表
C. 腐蚀时水表发生的电极反应为: 2H2O+O2+4e4OH
D. 腐蚀过程还涉及反应:4Fe(OH)2+2H2O+O24Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是

A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A. 用惰性电极电解MgCl2 溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 向氯化铝溶液中滴加少量Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓
C. 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O
D. FeCl3溶液与NaAlO2溶液混合:Fe3++ 3AlO2-=Fe(AlO2)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分,I是一种萜类化合物,它的合成路线如图所示:
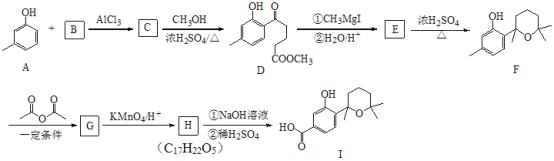
已知:
Ⅰ.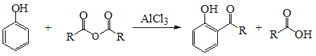
Ⅱ.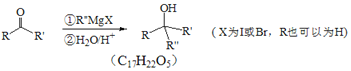
Ⅲ.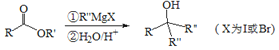
回答下列问题:
(1)A的名称是________,A+B→C的反应类型是___________;
(2)F的分子式_______________,其分子中所含官能团的名称是____________;
(3)H→I第一步的化学反应方程式_________________;
(4)B含有一个环状结构,其结构简式为_________________;
它的同分异构体有多种,其中符合下列条件的有___________种(不考虑立体异构)
①不含有环状结构 ②能发生银镜反应 ③能与NaHCO3反应生成CO2
(5)流程中设计F→G这步反应的作用_________________;
(6)F与(CH3CO)2O按物质的量1∶1发生反应生成G的化学方程式为____________;
(7)请以CH3COCH3、CH3CH2MgBr为原料,结合题目所给信息,制备高分子化合物 的流程。
的流程。
例如:原料![]() ……目标化合物
……目标化合物
___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学分别用如图所示装置测定空气中氧气的含量。先用弹簧夹夹住橡胶管,点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广瓶内水面的变化情况:

(1)上述实验过程中发生反应的化学方程式为__________________________________。
(2)甲同学实验中广瓶内水面上升明显小于瓶内空气体积的![]() ,乙同学实验中广瓶内水面上升明显大于瓶内空气体积的
,乙同学实验中广瓶内水面上升明显大于瓶内空气体积的![]() ,下列对这两种现象解释合理的是________
,下列对这两种现象解释合理的是________
A.甲同学可能使用的钠的量不足,瓶内氧气没有消耗完
B.甲同学可能未塞紧瓶塞,钠熄灭冷却后外界空气进入瓶内
C.乙同学可能没有夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出
D.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前瓶内部分空气受热逸出
(3)在实验室里,某同学取一小块金属钠做钠与水反应的实验。将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是①__________,②__________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com