
| A. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
分析 A.分解1mol KClO3放出热量38.8kJ,可知分解反应为放热反应;
B.慢反应为决定反应速率的主要因素;
C.由反应②可知,Mn2O7分解会生成一部分MnO2;
D.催化剂的接触面积增大,可加快反应速率.
解答 解:A.反应2KClO3=2KCl+3O2为放热反应,故1 mol KClO3所具有的总能量高于1 mol KCl和1.5 mol O2所具有的总能量之和,故A正确;
B.由分解机理可知,KClO3的分解速率取决于慢反应,即反应①,故B正确;
C.由反应②可知,0.1 g Mn2O7分解会生成一部分MnO2,故反应后MnO2的总质量大于1 g,故C错误;
D.由分解机理可知,KClO3的分解速率取决于慢反应,即反应①,将固体二氧化锰碾碎,可加快反应①的反应速率,故D正确;
故选C.
点评 本题考查反应速率的影响因素及反应机理,为高频考点,把握发生的反应、速率的决定因素、影响反应速率的因素为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:实验题
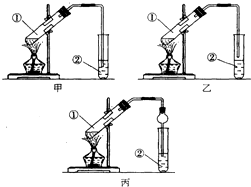 下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体有丁达尔效应是Fe(OH)3胶体区别于FeCl3溶液最本质的特征 | |
| B. | 阳光穿透清晨的树林时形成的光柱,是胶体的丁达尔效应的体现 | |
| C. | 鸡蛋清溶液分类上属于悬浊液 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com