


| △ |
| △ |
| 水 |
| △ |
| 水 |
| △ |


科目:高中化学 来源: 题型:
| A、Cl2+2NaOH═NaCl+NaClO+H2O |
| B、NH3+HCl═NH4Cl |
| C、Br2+2KI═I2+2KBr |
| D、CO2+Ca(OH)2═CaCO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| A、增大氧气浓度,平衡向正方向移动,K值不变 |
| B、降低温度,正反应速率比逆反应速率减小的程度小 |
| C、平衡时SO2气体的转化率为50% |
| D、该条件下反应放出0.5QkJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
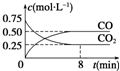 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、 2mol CO2 | 4mol FeO、 3mol CO |
| CO的浓度(mol?L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)A、B、C、D、E五种元素在周期表里的位置如图1所示:
(Ⅰ)A、B、C、D、E五种元素在周期表里的位置如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com