
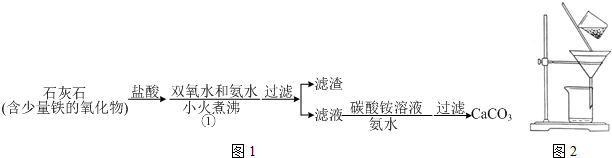
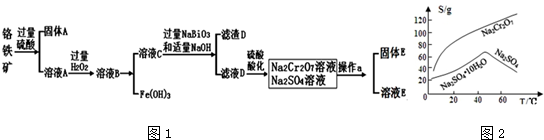
分析 (一)碳酸钙的制备
由流程可知,加盐酸,碳酸钙、铁的氧化物均溶解,加双氧水可氧化亚铁离子,加氨水将铁离子转化为沉淀,过滤后的滤液中含盐酸,加氨水中和酸,利用得到碳酸钙沉淀;
(1)碱可中和酸,小火煮沸利于沉淀生成;
(2)过滤遵循一贴二低三靠;
(二)过氧化钙的制备
由流程可知,碳酸钙溶于盐酸后,至溶液中尚存有少量固体,过滤后,滤液中氯化钙、氨水、过氧化氢反应生成CaO2、NH4Cl、水;再过滤,洗涤得到过氧化钙;制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品,石灰石便宜易得,但纯度较低,以此来解答.
解答 解:(一)碳酸钙的制备
由流程可知,加盐酸,碳酸钙、铁的氧化物均溶解,加双氧水可氧化亚铁离子,加氨水将铁离子转化为沉淀,过滤后的滤液中含盐酸,加氨水中和酸,利用得到碳酸钙沉淀;
(1)步骤①加入氨水的目的是中和多余的盐酸,沉淀铁离子.小火煮沸的作用是使沉淀颗粒长大,有利于过滤,
故答案为:调节溶液pH使Fe(OH)3沉淀;过滤分离;
(2)a.漏斗末端颈尖未紧靠烧杯壁,应漏斗末端颈尖紧靠烧杯壁,故错误;
b.玻璃棒用作引流,使液体顺利流下,故正确;
c.将滤纸湿润,使其紧贴漏斗壁,防止液体从滤纸与漏斗的缝隙流下,故正确;
d.滤纸边缘应低于漏斗上边缘,故错误;
e.玻璃棒不能在漏斗中轻轻搅动以加过过滤速度,可能捣破滤纸,过滤失败,故错误;
故答案为:ade;
(二)过氧化钙的制备
由流程可知,碳酸钙溶于盐酸后,至溶液中尚存有少量固体,过滤后,滤液中氯化钙、氨水、过氧化氢反应生成CaO2、NH4Cl、水;再过滤,洗涤得到过氧化钙;
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,溶液中溶解二氧化碳,此时溶液呈酸性;将溶液煮沸,趁热过滤,将溶液煮沸的作用是除去溶液中溶解的二氧化碳,
故答案为:酸;除去溶液中溶解的二氧化碳;
(4)步骤③中反应的化学方程式为CaCl2+2NH3.H2O+H2O2=CaO2+2NH4Cl+2H2O,该反应需要在冰浴下进行,原因是温度过高时双氧水易分解,
故答案为:CaCl2+2NH3.H2O+H2O2+6H2O=CaO2•8H2O↓+2NH4Cl;温度过高时双氧水易分解;
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是去除晶体表面水分,
故答案为:去除晶体表面水分;
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品.该工艺方法的优点是原料来源丰富、操作简单,产品的缺点是纯度较低,
故答案为:工艺简单、操作方便;纯度较低.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、实验技能、物质的性质为解答的关键,侧重分析与实验能力的考查,注意物质的性质及应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
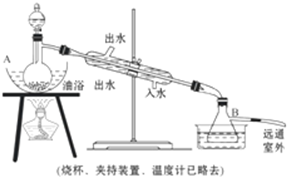
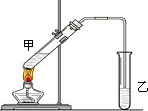 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: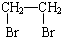 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
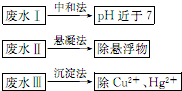 水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
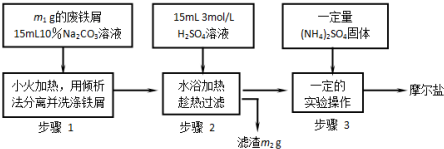
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
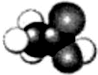 乙酸是食醋的主要成分,它的分子结构模型如图所示.
乙酸是食醋的主要成分,它的分子结构模型如图所示.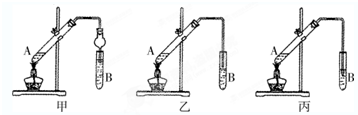
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com