
【题目】在有机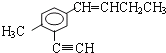 中,在同一平面上碳原子最多有几个,在同 一直线上的碳原子最多有几个( )
中,在同一平面上碳原子最多有几个,在同 一直线上的碳原子最多有几个( )
A.11,4B.13,3C.13,4D.12,3
【答案】C
【解析】
在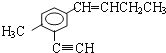 分子中,甲基中C原子处于苯中H原子的位置,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙基中连接双键的C原子处于碳碳双键形成的平面,乙基中的亚甲基具有四面体结构,乙基中甲基C原子通过旋转碳碳单键可能处于碳碳双键形成的平面,乙炔基为直线结构,处于苯环的平面结构,苯环中6个C原子、甲基中1个C原子、乙炔基中2个C原子、碳碳双键中2个原子、乙基中2个C原子,可能处于同一平面,所以最多有13个C原子;
分子中,甲基中C原子处于苯中H原子的位置,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙基中连接双键的C原子处于碳碳双键形成的平面,乙基中的亚甲基具有四面体结构,乙基中甲基C原子通过旋转碳碳单键可能处于碳碳双键形成的平面,乙炔基为直线结构,处于苯环的平面结构,苯环中6个C原子、甲基中1个C原子、乙炔基中2个C原子、碳碳双键中2个原子、乙基中2个C原子,可能处于同一平面,所以最多有13个C原子;
有机物 中,处于共线的碳原子最多的是乙炔基、乙炔基连接的苯环C原子及该C原子对位的苯环C原子,故最多有4个C原子共线;
中,处于共线的碳原子最多的是乙炔基、乙炔基连接的苯环C原子及该C原子对位的苯环C原子,故最多有4个C原子共线;
综上所述,在同一平面上的碳原子最多有13个,在同一直线上的碳原子最多有4个,故答案为D。


科目:高中化学 来源: 题型:
【题目】下列关于氨水的叙述中,正确的是
A.氨水能导电,故NH3是电解质
B.氨水中除水外物质的量浓度最大的粒子是NH3
C.氨水显弱碱性,是因为氨水是一种弱碱
D.在1mol/L的氨水中,NH3H2O、NH3、NH![]() 的物质的量浓度之和为1mol/L
的物质的量浓度之和为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,试回答下列问题:
Cl2↑+MnCl2+2H2O,试回答下列问题:
(1)该反应中氧化剂与还原剂的物质的量比为:__。
(2)写出该反应的离子方程式:___。
(3)当有0.2mol电子转移时,生成标准状况下Cl2的体积是___L。
(4)若用足量二氧化锰与50ml36.5%1.2g/ml浓盐酸反应,制得的Cl2在标准状况下总小于3.36L,原因可能是①__,②__。
(5)检验氯气是否收集满的方法是用___试纸靠近集气瓶口,若试纸变蓝证明氯气已收集满。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入Cl2(溶液体积变化忽略不计),生成I2、Fe3+的物质的量随通入Cl2的物质的量的变化如图所示,下列说法错误的是( )
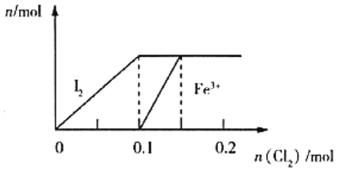
A.还原性强弱:Fe2+<I-
B.n(Cl2)=0.05mol时,溶液中I-的物质的量浓度为0.1mol·L-1
C.若n(Cl2):n(FeI2)=6:5,反应的离子方程式为2Fe2++10I-+6Cl2=5I2+2Fe3++12Cl-
D.n(Cl2)=0.12mol时,溶液中的离子主要有Fe3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备如下所示,下列说法正确的是
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
A.步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B.灼烧熔融的Na2CO3固体,可用石英坩埚
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为________________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有________。
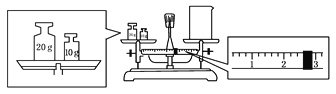
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为____________ g,要完成本实验该同学应称出____________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SO2的水溶液能导电,故SO2为电解质
B.阳离子在反应中只能得电子被还原作氧化剂
C.标准状况下,6.72L的NH3的物质的量为0.3mol
D.氯水、液氨、空气、盐酸都是混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com