
日常生活中使用的铝合金中的铝来自于电解氧化铝.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为Si02、Fe2O3、Ca0、Mg0、Na20等.工业生产铝锭的工艺流程示意图如下:
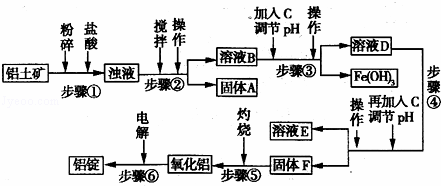
一些氢氧化物沉淀的pH如表:
沉淀物 Al(OH)3 Fe(OH)3 Mg(OH)2
开始沉淀pH(离子初始浓度为0.01mol/L) 4 2.3 10.4
完全沉淀pH(离子初始浓度为<10﹣5mol/L) 5.2 4.1 12.4
请回答下列问题:
(1)实验室进行步骤④的操作名称为 .
(2)固体A的化学式为 ,物质C的化学式为 .
(3)步骤④调节pH的范围为 .
(4)步骤⑥反应的化学方程式为 .
考点: 镁、铝的重要化合物;难溶电解质的溶解平衡及沉淀转化的本质;铁的氧化物和氢氧化物;物质分离和提纯的方法和基本操作综合应用.
专题: 几种重要的金属及其化合物.
分析: (1)由工艺流程可知,步骤④调节pH值后,将固体与液体分离,应采用过滤的方法;
(2)由工艺流程可知,步骤①加入盐酸,Si02不与盐酸反应,过滤得到的固体A为Si02;
由工艺流程可知,溶液B中含有Fe3+,加入C调节pH值后,通过过滤得到沉淀Fe(OH)3,故加入C调节pH值的目的是将Fe3+转化为Fe(OH)3,除去Fe3+,结合溶液B中含有的阳离子判断;
(3)步骤④中调节溶液pH,使铝离子沉淀完全而Mg2+离子不产生沉淀,结合离子开始沉淀与沉淀完全的pH解答;
(4)工业上采用电解熔融氧化铝的方法冶炼铝.
解答: 解:(1)由工艺流程可知,步骤④调节pH值后,将固体与液体分离,应采用过滤的方法,
故答案为:过滤;
(2)由工艺流程可知,步骤①加入盐酸,Si02不与盐酸反应,过滤得到的固体A为Si02;
由工艺流程可知,溶液B中含有Fe3+,加入C调节pH值后,通过过滤得到沉淀Fe(OH)3,故加入C调节pH值的目的是将Fe3+转化为Fe(OH)3,除去Fe3+,溶液B中含有Na+、Ca2+、Mg2+,故C最好选择NaOH 或Ca(OH)2溶液,
故答案为:Si02;NaOH 或Ca(OH)2;
(3)步骤④中调节溶液pH,使铝离子沉淀完全而Mg2+离子不产生沉淀,由表中数据可知,pH=4时铝离子开始沉淀,pH=5.2时铝离子完全沉淀,Mg2+开始沉淀溶液的pH=10.4,所以要使铝离子沉淀完全而Mg2+离子不产生沉淀,则步骤④调节pH的范围为:5.2<pH<10.4,
故答案为:5.2<pH<10.4;
(4)工业上采用电解氧化铝的方法冶炼铝,反应方程式为:2Al2O3(熔融) 4Al+3O2↑,
4Al+3O2↑,
故答案为:2Al2O3(熔融) 4Al+3O2↑.
4Al+3O2↑.
点评: 本题考查元素化合物性质、化学工艺流程等,理解工艺流程是解题的关键,需要学生根据工艺流程提取信息,对学生综合运用能力和推理有较高的要求,难度中等.


科目:高中化学 来源: 题型:
规范书写是我们学习中必须遵循的原则,小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因.
(1)“Co”表示 元素(填名称);
(2)“CO”是由 两种元素(填名称)组成的 (填“单质”或“化合物”).

查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是()
A. 乙酸与碳酸钠溶液反应:2H++CO32﹣═CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO﹣+2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O 2C6H5OH+CO32﹣
2C6H5OH+CO32﹣
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH﹣ CO32﹣+2NH4++4Ag↓+6NH3+2H2O
CO32﹣+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
中科院化学所研制的晶体材料﹣﹣纳米四氧化三铁,在核磁共振造影及医药上有广泛用途其生产过程的部分流程如下:FeCl3•6H2O FeOOH
FeOOH 纳米四氧化三铁,下列有关叙述不合理的是()
纳米四氧化三铁,下列有关叙述不合理的是()
A. 纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B. 纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C. 在反应①中环丙胺的作用可能是促进氯化铁水解
D. 反应②的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中反应的离子方程式的书写正确的是()
A. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混用会导致氯气中毒:ClO﹣+Cl﹣+2H+═Cl2↑+H2O
B. 水壶中水垢用食醋除去:2H++CaCO3═Ca2++CO2↑+H2O、
C. SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH═Na2SO4+H2O
D. 用FeSO4除去酸性废水中的Cr2O72﹣:Cr2O72﹣+Fe2++14H+═2Cr3++Fe3++7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
|
| A. | a mL | B. | (50﹣a)mL | C. | 大于(50﹣a)mL | D. | 大于a mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在2L的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)⇌2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到前2min末时,容器中n(SO2)为( )
|
| A. | 1.6mol | B. | 1.2mol | C. | 大于1.6mol | D. | 小于1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解.
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X、Y、Z三种金属的活动性顺序为()
A. X>Y>Z B. X>Z>Y C. Y>X>Z D. Y>Z>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com