
【题目】某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示:
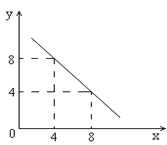
(1)该温度下水的离子积为__________;该温度_____________常温(填“高于”、“低于”或“等于”)。
(2)该温度下0.01 mol/L NaOH溶液的pH为_____。
(3)除了用pH外,科学家还建议用酸度(AG)来表示溶液的酸碱性:![]() 。则该温度下,0.01mol/L盐酸的酸度AG=_________。
。则该温度下,0.01mol/L盐酸的酸度AG=_________。
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】根据要求写出反应的化学方程式:
(1)甲苯(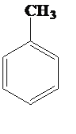 )在光照条件下和氯气发生一取代反应的化学方程式:_______________
)在光照条件下和氯气发生一取代反应的化学方程式:_______________
(2)以甲苯为原料制备邻氯甲苯(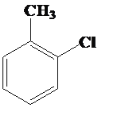 )的化学方程式:__________
)的化学方程式:__________
(3)以丙烯(![]() )为原料可以合成甘油(丙三醇,
)为原料可以合成甘油(丙三醇,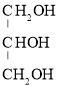 ),其合成步骤如下:
),其合成步骤如下:
![]() ___________
___________![]() 1,2,3-三氯丙烷
1,2,3-三氯丙烷![]() 丙三醇
丙三醇
己知:![]()
请写出第②步反应的化学方程式:___________________
(4)今有甲苯和丙三醇的混合物,测得其中H含量为a%,则![]() ___________(小数点后保留1位)
___________(小数点后保留1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是

A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述错误的是( )
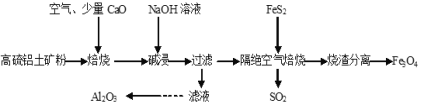
A.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
B.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
D.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。
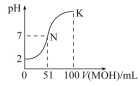
(1)由图中信息可知HA为____________酸(填“强”或“弱”)。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7,用离子方程式表示其原因_________________,此时,溶液中水电离出的c(OH-)=__________mol·L-1。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_____________________
(4)K点所对应的溶液中,c(M+)+c(MOH)__________2c(A-)
(二)Ⅰ.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001 moL·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO4-+5HS03-+H+= 2Mn2++5SO42-+3H2O。
请完成下列问题:
(1)该滴定实验所需仪器有下列中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)本实验________(填“需要”或“不需要”)使用指示剂,理由是___________________
Ⅱ.一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1 mol·L-1稀硫酸标准溶液。然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是________(填序号)。
A.实验中所用到的滴定管、容量瓶在使用前均需要查漏
B.若选用100 mL容量瓶配制标准酸溶液,需用密度为1.84 g·mL-1、98%的浓硫酸5.43 mL
C.容量瓶中有少量的蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大
E.若配制标准酸溶液在定容时俯视读数,则导致所测的NaOH溶液浓度偏大
F.中和滴定实验,若滴定前平视读数、滴定结束俯视读数,则导致实验结果偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,在元素周期表中处于如图位置的元素性质往往相似。由此推测下面有关锂及其化合物的性质的叙述错误的是( )
A.锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2
B.在相同温度下,溶解度Li2CO3小于LiHCO3
C.Li2CO3受热很难分解
D.少量的锂保存在石蜡中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A. 1 mol NH5中含有5 NA个N﹣H键(NA表示阿伏加德罗常数)
B. NH5中既有共价键又有离子键
C. NH5的电子式为![]()
D. 它与水反应的离子方程式为NH4++H﹣+H2O=NH3H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2辅助的Al—CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。该电池多孔碳电极的反应式为: 6O2 + 6e = 6O2 6CO2+6O2 = 3C2O42+6O2。该装置工作时下列说法不正确的是
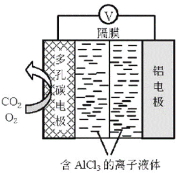
A.多孔碳电极有利于气体扩散至电极表面
B.铝电极为上的电势比多孔碳电极上的高
C.反应过程中O2的作用是催化剂
D.该电池的总反应式为:2Al+6CO2=Al(C2O4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
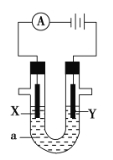
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
①电解池中Y电极上的电极反应式为 。在Y电极附近观察到的实验现象是 ;检验该电极反应产物的方法是 。
②X电极上的电极反应式为 。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:
①X电极的材料是 ,电极反应式为 ;
②Y极的材料是 ,电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com