
| A. | ①>②>③>④ | B. | ③>①>④>② | C. | ①>③>④>② | D. | ②>③>④>① |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
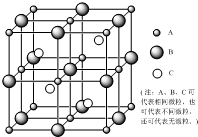 晶体的世界丰富多彩,晶体的结构纷繁复杂.人教版课程标准高中教材《选修3》向我们展示了一些典型晶体的结构及性质的相关知识,如:干冰、冰、金刚石、石墨、钋、钾、镁、铜、NaCl、CsCl、CaF2.下图是一个立方晶胞图,请大家在上述所列物质范围内回答下列问题:
晶体的世界丰富多彩,晶体的结构纷繁复杂.人教版课程标准高中教材《选修3》向我们展示了一些典型晶体的结构及性质的相关知识,如:干冰、冰、金刚石、石墨、钋、钾、镁、铜、NaCl、CsCl、CaF2.下图是一个立方晶胞图,请大家在上述所列物质范围内回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与甲烷发生取代反应,是制取二氯甲烷的有效方法 | |
| B. | 红热的铁丝、铜丝都能在氯气里剧烈燃烧,生成大量白色的烟 | |
| C. | 氯气和次氯酸钠都可用于杀菌、消毒,使用时要注意用量 | |
| D. | 聚氯乙烯是使用量非常大,应用领域最为广泛的塑料,也是熟、热食品常用的包装材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 | |
| B. | 除去硝酸钾晶体里少量的氯化钠:加水溶解,蒸发结晶至有大量晶体析出,停止加热用余热蒸干 | |
| C. | 除去氮气中少量氧气:使气体通过炽热的铜粉 | |
| D. | 除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
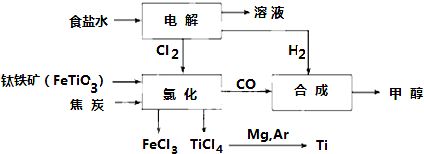
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
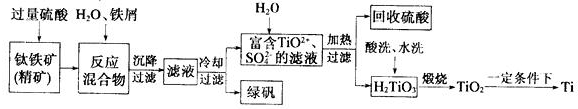
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com