
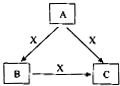
| ||
| ||
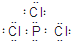 ,
,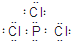 ;
;| n(NaOH) |
| n(CO2) |
| 3 |
| 2 |
|
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ |
| B、向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| C、Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D、石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
| A、上述反应中As2S3发生还原反应,作还原剂 |
| B、该反应的氧化产物为H3AsO4和S |
| C、该反应可以说明HNO3的酸性强于H3AsO4的酸性 |
| D、若生成2mol H3AsO4,则反应中转移电子的物质的量为4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
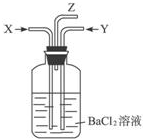
| A、①④ | B、①② | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )
将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )| A、图1盐桥中的阳离子移向甲装置 | ||||
| B、两图都是将化学能转变成电能的装置 | ||||
C、图2中乙装置总反应的离子方程式:Cu2++2Cl-
| ||||
| D、图2中电子流向为Fe→电流计→石墨a→石墨b→→石墨c→Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、N2的电子式: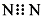 | ||
B、中子数为18的氯原子结构示意图: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3 ═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
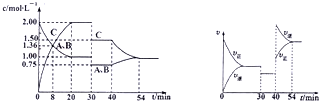
| A、前8minA的平均反应速率为0.08mol?L-1min-1 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、30-40min之间该反应增大了压强或使用了催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com