


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
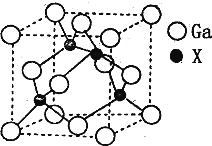
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X、Y位于ⅠA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | B、若X、Y位于第三周期,则X、Y形成的化台物可能是离子化合物或共价化合物 | C、若气态氢化物的沸点:X>Y,则X、Y只能位于周期表的ⅦA族 | D、若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:
(1)Y的价电子轨道表示式为 ;
(2)YX2的电子式是 ,分子构型为 ,中心原子发生了____杂化。
(3)Y与Z形成的化合物的分子式是_______,该化合物中化学键是________键(填“极性”或“非极性”),该分子属于__________分子(填“极性”或“非极性”)。
(4)Y的氢化物中分子构型为正四面体的是__ _____(填名称),键角为_______,中心原子的杂化形式为_______。
(5)元素X与Y的电负性的大小关系是___________(用元素符号填写,并填﹥、﹤、﹦),
X与Z的第一电离能的大小关系是___________。(用元素符号填写,并填﹥、﹤、﹦)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com