
A.碘化氢 B.烧碱 C.液溴 D.食盐
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:阅读理解
(15分)某校化学研究性学习小组的同学在学习了氨的性质持讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ;
(2)在实验室中,还可以用浓氨水与 (填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式: 。
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
。
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72g。据此可推得,A的化学式为 。由此,得到的结论是
。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省四地六校高三期中联考试题化学试卷 题型:实验题
(15分)某校化学研究性学习小组的同学在学习了氨的性质持讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ;
(2)在实验室中,还可以用浓氨水与 (填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:

(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式: 。
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
。
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72g。据此可推得,A的化学式为 。由此,得到的结论是
。
查看答案和解析>>
科目:高中化学 来源:2013届福建省高一下学期第一学段考试化学试卷 题型:实验题
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了如下图所示的实验装置(部分夹持及尾气处理装置未画出),探究氨气的还原性:
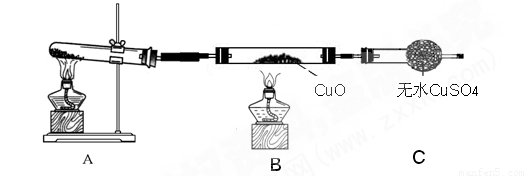 (3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
(三)问题讨论
(5)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+ 的稳定性比Cu2+ 差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O
。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O
。
(6)解决了问题(5)后,有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素是生命活动、物质间转化的常见元素。
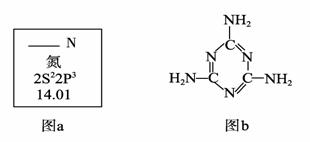
(1)图a是元素周期表中N元素的有关信息,图a中横线上缺失的具体内容是 。
15N是N元素的一种重要核素,其一个原子核中含有的中子数为 。
(2)三聚氰胺的结构简式如上图b,根据你的了解,下列关于三聚氰胺的表述中,
正确的是 (填字母序号)。
A.三聚氰胺的熔点可能很高 B.三聚氰胺的含氮量高达67%左右
C.三聚氰胺属于无机化合物 D.三聚氰胺分子中所有原子在同一平面上
(3)①最近科学家们合成了由氮元素形成的N5n+,电子式![]() 为
为
则n值为 。
②H与N能形成化合物NH5 ,已知该物质与水反应有H2生成,则NH5中含有的化学键为 。
(4)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为
35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。

①写出D与X反应的化学方程式
②写出G与H反应的离子方程式 。
③实验室中I应如何保存? 。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式 。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等。制备流程如下图:
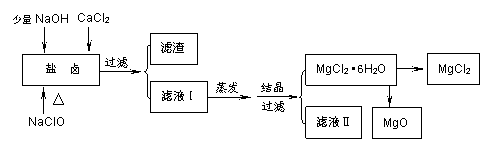
(1)滤渣的成分是 (写化学式);滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为 ;加入NaClO的另一个作用是 。
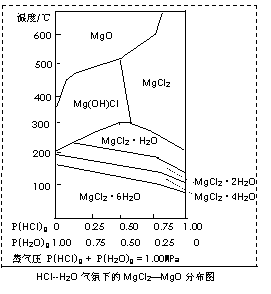
(3)温度和压强P(HCl)g对MgCl2?6H2O晶体热分解产物的影响如图所示。请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2?6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;若要得到无水MgCl2须采取的措施是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com