
| A | B | C | D | |
| 用品名称 | 煤炭  | 酚醛树脂手柄 | 明矾  | 手工肥皂  |
| 主要成分 | C 碳单质 | 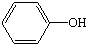 苯酚 | Al2(SO4)3•12H2O 十二水合硫酸铝 | C17H35COONa 硬脂酸钠 |
| A. | A | B. | B | C. | C | D. | D |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
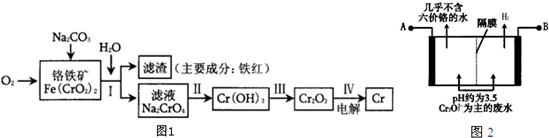
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
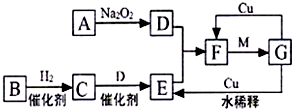 下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体.
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体.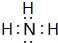 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
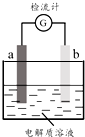 30℃时,利用图装置进行实验,结果记录如下表所示:
30℃时,利用图装置进行实验,结果记录如下表所示:| 实验 | a电极 | b电极 | 电解质溶液 | 现象 |
| I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅱ | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅲ | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
| Ⅳ | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
| A. | Ⅱ中Al为负极,其电极反应是:Al-3e-═Al3+ | |
| B. | Ⅱ中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行 | |
| C. | Ⅳ中Fe为负极,发生了氧化反应 | |
| D. | 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:r(Z2+)>r(Y2-) | |
| B. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物强 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | X、Y、Z、W元素的最高正价均等于其所在族的族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
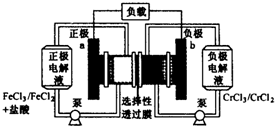 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )| A. | 电池充电时,b极的电极反应式为Cr3++e-=Cr2+ | |
| B. | 电池充电时,Cl-从a极穿过选择性透过膜移向b极 | |
| C. | 电池放电时,a极的电极反应式为Fe3++3e-=Fe | |
| D. | 电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Ca2+、Mg2+、HCO3-、Cl- | |
| B. | 使KSCN变红色的溶液中:NH4+、S2-、Br-、I- | |
| C. | c(H+)/c(OH-)=1012 的溶液中:Cu2+、Al3+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)•c(OH-)=10-8的溶液中:Na+、K+、AlO2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com