
| A. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| B. | NH4Cl、CH3COONa、NaHCO3、NaHSO3溶于水,对水的电离都有促进作用 | |
| C. | 浓度均为0.10mol•L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者大于后者 | |
| D. | 可用Na2CO3溶液处理水垢中的CaSO4,转化为易于除去的CaCO3 |
分析 A、Kw只受温度影响,据此回答;
B、亚硫酸氢根离子的电离程度大于水解程度,亚硫酸氢钠溶液显示酸性;
C、硫酸氢铵中电离出的氢离子对铵根离子的水解起到抑制作用;
D、Na2CO3溶液可以和CaSO4反应生成更难溶的碳酸钙沉淀.
解答 解:A、Kw只受温度影响,Na2CO3溶液加水稀释后,恢复至原温度,温度不变时Kw不变,故A错误;
B、NH4Cl、CH3COONa、NaHCO3溶于水,离子的水解对水的电离都有促进作用,但是NaHSO3对水的电离起到抑制作用,故B错误;
C、浓度均为0.10mol•L-1 NH4Cl和NH4HSO4溶液中,硫酸氢铵中电离出的氢离子对铵根离子的水解起到抑制作用,c(NH4+)前者小于后者,故C错误;
D、Na2CO3溶液可以和CaSO4反应生成更难溶的碳酸钙沉淀,再加入酸(醋酸等)即可除去,故D正确.
故选D.
点评 本题涉及水解原理以及水解平衡的影响、沉淀的转化等方面的知识的应用,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:解答题
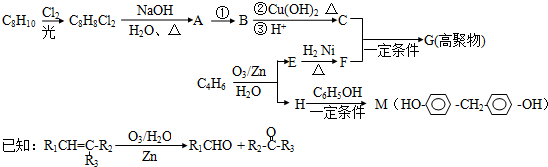
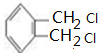
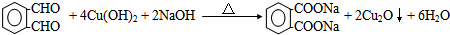
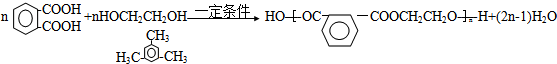
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池要进入广泛的实际应用,高容量储氢材料的研制是需解决的关键技术问题之一 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 2013年6月航天员王亚平在太空做的水膜实验说明:水分子的组成和结构在太空中发生了改变,水才有不同于其在地球上的物理现象 | |
| D. | 元素分析仪可检验C、H、O、N、S等非金属元素,也可以检验Cr、Mn等金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种基础能源.
无色,无气味并且易燃.是常见的一种基础能源. 有强氧化性的弱酸,可以用于消毒杀菌.
有强氧化性的弱酸,可以用于消毒杀菌.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C7H15OH | B. | C6H13OH | C. | C5H12OH | D. | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
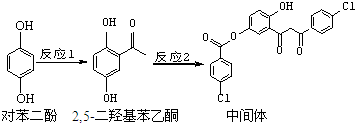
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol | |
| B. | 室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是a=4b+c | |
| C. | 已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37 | |
| D. | 在25℃下,将2a mol•L-1的氨水与0.02 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{10-9}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgOH溶于氨水:AgOH+2NH3•H2O=[Ag(NH3)2]++OHˉ+2H2O | |
| B. | Na2C2O4水解:C2O42-+2H2O=H2C2O4+2OH- | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com