
【题目】下列叙述的化学用语中,正确的是
A. 用石墨作电极电解AlCl3溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 在高温氧化锆的环境下,CO的燃料电池的负极反应2CO+2O2--4e-=2CO2
C. 硫化钠的水解方程式:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. 电解硫酸钠水溶液的阳极反应:2H++2e-=H2↑
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL;
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为__________________________________,
本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、____________________。
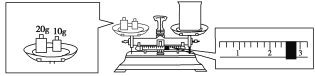
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。
(3)下列对容量瓶及其使用方法的描述中正确的是(____)
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是_______________。
①转移溶液时不慎有少量洒到容量瓶外面
②定容时俯视刻度线
③未冷却到室温就将溶液转移到容量瓶并定容
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。完成合成氨工业中有关问题。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①高温高压、催化剂条件下,工业合成氨的热化学方程式为:____________________________________________。
②若起始时向容器内放入0.2 mol N2和0.6 mol H2,达到平衡后放出的热量为Q,则Q值______18.44 kJ(填“﹥”“=”或“﹤”)。
(2)NH3(g)与CO2(g) 经过两步反应合成尿素(CO(NH2)2),两步反应的能量变化示意图如下:
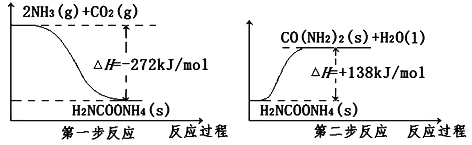
①则2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
②在一定温度和压强下,若①中的反应,NH3和CO2的物质的量之比(氨碳比)n(NH3)/n(CO2)=x。下图是氨碳比(x)与CO2平衡转化率(α)的关系。

α随着x增大而增大的原因是_________________________________。
③图中B点处,NH3的平衡转化率_______________。
(3)将N2和H2各1 mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中,N2的体积分数将_______________(填序号)。
a.一直减小 b.始终不变 c.一直增大 d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)①H2 + CuO ![]() Cu + H2O
Cu + H2O
②CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
③3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O
2Na2S + Na2SO3 + 3H2O
④NH4NO3 + Zn = ZnO + N2↑+ 2H2O
⑤Cu2O + 4HCl = 2HCuCl2 + H2O
上述反应中,属于氧化还原反应的是__________________________(填序号)
(2)SeO2、KI和HNO3可发生反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O,配平该反应的化学方程式并用双线桥法标出电子转移的方向和数目:____________________________。
(3)在反应 KIO3 + 6HI = 3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为__________。
Ⅱ.已知:
① 2H2O + Cl2 + SO2 = H2SO4 + 2HCl ② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(4)根据以上两个反应可以得出氧化剂和还原剂的强弱顺序,请写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:_______________________。
在反应②中,若有18.25g HCl被氧化,求:
(5)转移的电子数为:_______________。
(6)标况下生成Cl2的体积(请列式计算)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO- + H2O + 2e- = Cl- + 2OH-,关于该电池的叙述正确的是
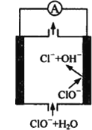
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置F、I中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 装置J收集的气体中一定不含NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将KOH溶液滴加到己二酸(H2X) 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
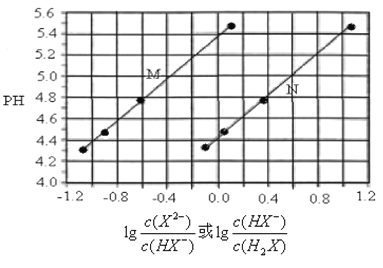
A. Ka2(H2X)的数量级为10–4
B. KHX溶液中c(H+)>c(OH-)
C. 曲线N表示pH与1g[c(X2-)/c(HX-)]的变化关系
D. 当混合溶液呈中性时,c(K+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属防护的方法中,应用了牺牲阳极的阴极保护法的是
A. 钢铁船身嵌入锌 B. 钢闸门与直流电源负极相连
C. 健身器材刷油漆 D. 车圈、车铃钢上镀铬
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com