
A、用石墨电极电解MgCl2饱和溶液的总反应为:Mg2++2Cl-
| ||||
| B、精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA | ||||
| C、氢氧酸性燃料电池放电时,正极反应为:O2+4e-+4H+=2H2O | ||||
| D、铅蓄电池在放电过程中,负极质量增加,正极质量增加 |
| ||


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、③④⑥⑨ | B、③④⑥⑧ |
| C、③④⑤⑥⑨ | D、③④⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
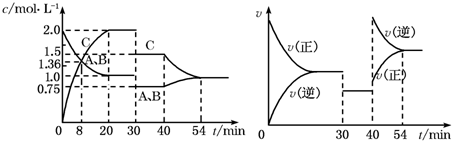
| A、30min~40min间该反应使用了催化剂 |
| B、反应方程式中的x=1,正反应为放热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、8min前A的平均反应速率为0.08mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(3m+n)mol | ||||
B、(
| ||||
C、(3m+n-
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4个 | B、5个 | C、6个 | D、7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 |
| B、用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 |
| C、邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小 |
| D、向某溶液中加入茚三铜试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M>N>P>Q |
| B、P>M>N>Q |
| C、N>Q>P>M |
| D、M>P>Q>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com