
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 =2ClO2 + 2NaCl。如图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)

(1)仪器P的名称是_________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:_______________________
(3)B装置中所盛试剂是______________, C装置的作用____________, G装置的作用_______________。
(4)F为ClO2收集装置,应选用的装置是___________(填序号),其中与E装置导管相连的导管口是________(填接口字母)。
 。
。
【答案】分液漏斗 MnO2+4H++2Cl-![]() Mn2+ +Cl2 ↑+2H2O 饱和食盐水 除去Cl2 中的水蒸汽 做安全瓶防倒吸 ② d
Mn2+ +Cl2 ↑+2H2O 饱和食盐水 除去Cl2 中的水蒸汽 做安全瓶防倒吸 ② d
【解析】
制备和收集一定量较纯净的ClO2,结合实验原理2NaClO2+Cl2═2ClO2+2NaCl,可知A中固液加热反应制备氯气,可由MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O制备,B中饱和食盐水可除去HCl,C中浓硫酸可干燥氯气,D中制备ClO2,E中E中盛有CCl4液体可吸收未反应的氯气,F可选图2中的②收集气体,且d导管进入,G可作安全瓶,防止尾气吸收导致倒吸,最后选碱液吸收尾气。
Mn2++Cl2↑+2H2O制备,B中饱和食盐水可除去HCl,C中浓硫酸可干燥氯气,D中制备ClO2,E中E中盛有CCl4液体可吸收未反应的氯气,F可选图2中的②收集气体,且d导管进入,G可作安全瓶,防止尾气吸收导致倒吸,最后选碱液吸收尾气。
(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,由图可知,仪器P的名称是分液漏斗;
(2)浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl(浓)![]() MnCl2++Cl2↑+2H2O,则装置A中烧瓶内发生反应的离子方程式为MnO2+4H++2Cl-
MnCl2++Cl2↑+2H2O,则装置A中烧瓶内发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)生成的氯气中混有HCl和水,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质,然后用浓硫酸干燥除去水,则B装置中所盛试剂是饱和食盐水,C装置中浓硫酸的作用是除去Cl2 中的水蒸汽,G装置的作用做安全瓶防倒吸;
(4)F为ClO2收集装置,因气体的密度比空气密度大,应选用的装置是②,其中与E装置导管相连的导管口是d。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,碘单质可与环戊烯![]() 反应生成环戊二烯
反应生成环戊二烯![]() :
:![]() 。现向1L密闭容器中加入
。现向1L密闭容器中加入![]() 和环戊烯
和环戊烯![]() 各
各![]() 使其发生上述反应,实验测得反应体系中
使其发生上述反应,实验测得反应体系中![]() 的物质的量
的物质的量![]() 随时间
随时间![]() 的变化如图所示,下列说法错误的是
的变化如图所示,下列说法错误的是

A.当环戊烯![]() 和环戊二烯
和环戊二烯![]() 的生成速率相等时,反应达到平衡
的生成速率相等时,反应达到平衡
B.![]() min内生成HI的反应速率
min内生成HI的反应速率![]()
![]()
C.10min时,环戊烯![]() 的转化率为
的转化率为![]()
D.![]() 后图线变化可能是反应体系温度升高所致
后图线变化可能是反应体系温度升高所致
查看答案和解析>>
科目:高中化学 来源: 题型:
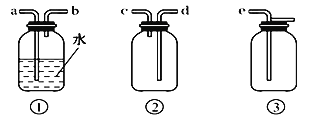
【题目】图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

a.灼烧海带时,除需要三脚架、泥三角外,还需要用到实验仪器是_____(填字母)。
A.烧杯 B.坩埚 C.表面皿 D.酒精灯 E. 干燥器
b.步骤③的实验选择上述图_____(填“甲”“乙”或“丙”)装置。步骤⑤的实验操作名称是_____。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是_____,选择上述图_____(填“甲”“乙”或“丙”)装置。
(2)某盐的混合溶液中含有Na+、Mg2+、Cl-、SO42-离子,测得Na+、Mg2+ 和Cl-的物质的量浓度依次为0.2molL-1、0.25molL-1、0.4molL-1,则c(SO42-)=_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应:
A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
① 混合气体的压强;② 混合气体的密度;③ B的物质的量浓度;④ 气体总物质的量;⑤ 混合气体的平均相对分子质量;⑥ C、D反应速率的比值
A. ②③⑤ B. ①②③ C. ②③④⑥ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是( )

A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取增大反应体系压强的措施
D. 若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起广泛关注。在爆炸的核电站周围含有放射性物质 碘-131和钙-137。碘-131 —旦被人体吸入,可能会引发甲状腺肿大等疾病。
(1)与钠同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ.mol) | 520 | 496 | 419 |
基态Z原子倒数第二层电子的排布式为______。X、Y、Z三种元素形成的单质熔点由高到低的顺序为_______(用元素符号表示),其原因为___________ .
(2)F与I同主族,BeF2分子中心原子的杂化类型为_________ ,BeF2分子是________分子(选填“极性”或“非极性”)。
(3)已知高碘酸有两种形式,化学式分别为H5IO6  和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
和HIO4 ,二者酸性强弱顺序为:H5IO6 ________HIO4(选填">"或"<"“=”)。从电子云的重叠方式的角度分析,H5IO6分子中的化学键有________(写出两种).
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中平均含有________个131I原子,晶体中碘分子的排列有_________种不同的方向。

(5)KI的晶胞结构如图乙所示,每个K+周围紧邻的K+个数为_______个。KI晶体的密度为ρg.cm-3 ,K和I的原子半径分别为rkcm和rI cm,阿伏加德罗常数的值为NA,则 KI晶胞中的空间利用率为_______. [空间利用率=(球体积/晶胞体积)×100%,用相关字母的代数式表示即可]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
(1)基态S原子的价电子排布式为____________,能量最高的电子所处的能层的符号为_________。
(2)SO42-空间构型为__________,中心原子的轨道杂化方式是________,写出一个与SO42-互为等电子体的分子的化学式__________。
(3)氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:_____________________________。
(4)O、N、S的第一电离能从大到小的顺序是___________________。
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为________。
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为________。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 的密闭容器中,放入镍粉并充入
的密闭容器中,放入镍粉并充入![]() 定量的CO气体,一定条件下发生反应:
定量的CO气体,一定条件下发生反应:![]() ,已知该反应平衡常数与温度的关系如表所示:下列说法正确的是
,已知该反应平衡常数与温度的关系如表所示:下列说法正确的是![]()
![]()
温度 | 25 | 80 | 230 |
平衡常数 |
| 2 |
|
A.上述生成Ni![]()
![]() 的反应为吸热反应
的反应为吸热反应
B.![]() 时反应Ni
时反应Ni![]()
![]() 的平衡常数为
的平衡常数为![]()
C.在![]() 时,测得某时刻,
时,测得某时刻,![]() 、CO浓度均
、CO浓度均![]()
![]() ,则此时
,则此时![]()
D.![]() 达到平衡时,测得
达到平衡时,测得![]() 3mol,则
3mol,则![]() 的平衡浓度为2
的平衡浓度为2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com