
【题目】下列表示物质结构的化学用语或模型正确的是
A. 苯分子的比例模型:
B. CO2的电子式:![]()
C. Cl-离子的结构示意图:
D. 乙烯的结构式:CH2=CH2
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用平衡移动原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
C. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
D. 锌与稀硫酸反应,加入少量硫酸铜反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘单质,工艺流程如下。下列关于海带制碘的说法错误的是
干海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 滤液
滤液![]() 碘水
碘水![]() I2的CCl4溶液
I2的CCl4溶液
A. 实验室灼烧干海带在坩埚中进行
B. 沸水浸泡的目的是使I—充分浸出
C. 由滤液获得碘水,发生的离子反应为2I—+H2O2═I2+2OH—
D. 碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、W、Z为四种短周期主族元素,在周期表中的位置如图所示。W原子的最外层电子数与电子层数相同,下列说法正确的是
![]()
A. X只能形成一种氢化物
B. W、X、Y的原子半径依次增大
C. X的简单氢化物的热稳定性比Y的小
D. W的最高价氧化物对应的水化物能溶于稀氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保持营养均衡,合理使用药物是人类健康的重要保证。
(1)人体内提供能量的主要营养物质为糖类、蛋白质和____,人体内蛋白质在蛋白酶作用下水解的最终产物是____。
(2)合理选择饮食,有益身体健康。小明家某次晚餐菜谱如下图所示。
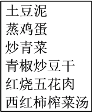
①菜谱中富含脂肪的食物是_______。
②土豆泥中的主要营养物质水解生成葡萄糖的化学方程式为_________。
③青椒、西红柿等蔬菜富含维生素C。用淀粉溶液和碘水检验维生素C的还原性,有关实验操作和现象是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用3.0g乙酸和4.6g乙醇反应,若实际产率是理论产率的67%,则可得到的乙酸乙酯的质量为:
A. 2.95gB. 4.4gC. 7.48gD. 8.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
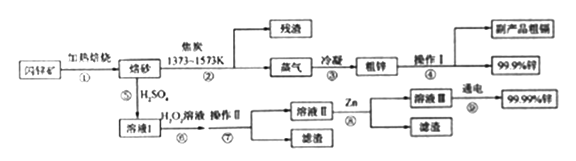
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示。下列说法不正确的是( )

A. 电解过程中,每转移1mol电子,则左侧电极就产生16g O2
B. 溶液中H+从阳极向阴极迁移
C. Ag-Pt电极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
D. B为电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得:
2CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O +CO2↑。
I.制备碳酸亚铁:装置如图所示。
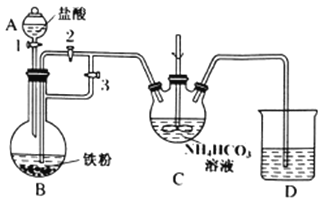
(1)C的名称是___________。
(2)清洗仪器,检查装置气密性,A中加入盐酸,B中加入铁粉,C中加入NH4HCO3溶液。为顺利达成实验目的,上述装置中活塞的打开和关闭顺序为:关闭活塞______,打开活塞______;加入足量盐酸后,关闭活塞1,反应一段时间后,关闭活塞____,打开活塞_____。C中发生的反应的离子方程式为_______________。
Ⅱ.制备乳酸亚铁晶体:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸。
(3)加入少量铁粉的作用是______________。从所得溶液中获得乳酸亚铁晶体所需的实验操作是隔绝空气低温蒸发,________、干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其原因可能是_____________________。
(5)经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点,记录数据如下表。
滴定次数 | 0.1000mol/LCe(SO4)2标准溶液体积/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁晶体的纯度为_________(以质量分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com