
【题目】下列有关物质的性质和用途具有对应关系的是
A. SO2具有氧化性,可用于漂白纸浆
B. CO具有还原性,可用于冶炼铁等金属
C. SiO2熔点高,可用作光导纤维
D. Al2O3具有两性,可用作耐高温材料
科目:高中化学 来源: 题型:
【题目】胡椒酚A是植物挥发油中的一种成分。对其分子组成结构的研究发现:A的相对分子质量不超过150;其中碳的质量分数为80.60%,氧的质量分数为11.94%,A在空气中完全燃烧后产物只有CO2和H2O。
(1)A的分子式为;(写过程)
(2)红外光谱发现A中不含甲基,A遇FeCl3溶液呈紫色,会使溴水褪色且1molA与足量浓溴水反应时最多可消耗3molBr2。另外A在适当条件下与硝酸反应生成的一硝基取代物只有两种,试写出A的结构简式;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列七种有机物中:①CH4 ②CH2=CH2 ③![]() ④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
(1)可与浓硝酸发生颜色反应的是______________(填序号,下同)。
(2)属于同系物的是__________
(3)互为同分异构体的是___________。.
(4)易发生银镜反应的是______________
II.在5L的密闭容器中充入1mol A 和2mol B,在一定条件下发生反应4A(g)+5B(g)![]() 4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
(5)D的平均反应速率为 .
(6)A的转化率为
(7) 不能判断该反应已达平衡状态的是
A 单位时间内生成n molA的同时生成2n mol D的状态
B 生成物浓度不再变化的状态
C 混合气体的平均相对分子质量不再改变的状态.
D 混合气体的压强不再改变的状态
E 容器中各组分的体积分数不随时间变化的状态
F 容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾。
(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2![]() 2SO3,经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s)
2SO3,经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·s)
① 则这段时间为_______s。
② 该反应达到平衡状态的标志是_______。
A.容器内硫元素物质的量分数不变 B.混合物的平均相对分子质量不变
C.n(SO2):n(O2):n(SO3)=2:1:2 D.各组分的体积分数不变
(2)利用烧渣制绿矾的过程如下:
![]()
操作I的名称____________,溶液A的溶质___________,固体B是__________。
(3)某科研机构用NaOH溶液吸收废气中的SO2,将所得的Na2SO4溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示,(电极材料为石墨)

① 图中b极要连接电源的___________极(填“正”或“负” )
②SO32-放电的电极反应式为__________。
③ 若用甲烷-空气燃料电池作电源,处理标准状况下40m3的废气(其中SO2的体积分数为0.2 ) ,理论上需要消耗标准状况下甲烷___________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类水解无关的是
A.Na2CO3、NaHCO3被视作“碱”用于面食制作
B.NaHSO4溶液显酸性
C.铝盐可用作净水剂
D.TiCl4溶液经蒸干、焙烧制得TiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于①乙烯 ②苯 ③乙醇 ④乙酸 ⑤葡萄糖等有机物的叙述不正确的是
A. 可以用新制的Cu(OH)2悬浊液来鉴别③④⑤
B. ①③⑤能使酸性KMnO4溶液褪色
C. ②③④能发生取代反应,①⑤不能发生取代反应
D. 一定条件下,⑤可用于生产③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)化合物H是合成抗心律失常药物决奈达隆的一种中间体,可通过以下方法合成:
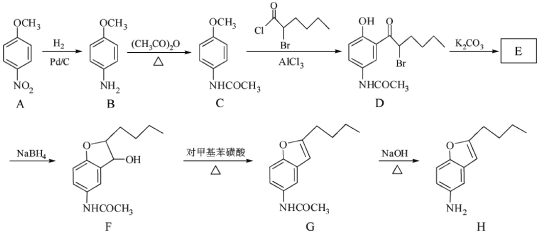
(1)D中的含氧官能团名称为____________(写两种)。
(2)F→G的反应类型为___________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_________。
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式:___________。
(5)已知:①苯胺(![]() )易被氧化
)易被氧化
②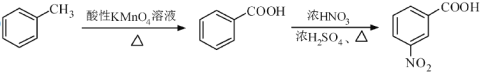
请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11,则该温度下水的KW=_______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va:Vb=___________。
(2)25℃时,0.1mol/L的HaA溶液中c(H+)/c(OH-)=1010,请回答下列问题:
①HaA是___________(填“强电解质”或“弱电解质”)。
②在加水稀释HaA溶液的过程中,随着水量的增加而增大的是__________(填字母)
A.c(HaA) B.c(H+)/c(HaA) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③NanA溶液显__________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com