
 ,32g甲在足量浓硝酸中反应转移的电子数为2NA.
,32g甲在足量浓硝酸中反应转移的电子数为2NA.分析 将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g,该沉淀为硫酸钡,其物质的量为:$\frac{46.6g}{233g/mol}$=0.2mol,根据质量守恒可知甲中含有0.2molS原子;滤液中再滴加NaOH溶液,又出现蓝色沉淀,该蓝色沉淀为氢氧化铜,说明甲中含有Cu离子,32g甲中含有铜元素的物质的量为:$\frac{32g-32g/mol×0.2mol}{64g/mol}$=0.4mol,则甲的化学式为:Cu2S;
含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,该红棕色固体为Fe2O3,氧化铁含有铁元素的物质的量为额:$\frac{28g}{160g/mol}$×2=0.35mol,可能为铁离子和亚铁离子的混合物;经分析乙与红棕色固体的组成元素相同,则乙中含有Fe、O元素;向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g,反应消耗铜的物质的量为:$\frac{8.0g-1.6g}{64g/mol}$=0.1mol,根据反应2Fe3++Cu═2Fe2++Cu2+可知,0.1mol铜完全反应消耗0.2molFe3+;所以乙与盐酸反应生成的为0.2molFe3+、0.15molFe2+,铁的平均化合价为:$\frac{0.2mol×3+0.15mol×2}{0.35mol}$=$\frac{18}{7}$,则乙的化学式为:Fe7O9,据此分析解答.
解答 解:将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g,该沉淀为硫酸钡,其物质的量为:$\frac{46.6g}{233g/mol}$=0.2mol,根据质量守恒可知甲中含有0.2molS原子;滤液中再滴加NaOH溶液,又出现蓝色沉淀,该蓝色沉淀为氢氧化铜,说明甲中含有Cu离子,32g甲中含有铜元素的物质的量为:$\frac{32g-32g/mol×0.2mol}{64g/mol}$=0.4mol,则甲的化学式为:Cu2S;
含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,该红棕色固体为Fe2O3,氧化铁含有铁元素的物质的量为额:$\frac{28g}{160g/mol}$×2=0.35mol,可能为铁离子和亚铁离子的混合物;经分析乙与红棕色固体的组成元素相同,则乙中含有Fe、O元素;向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g,反应消耗铜的物质的量为:$\frac{8.0g-1.6g}{64g/mol}$=0.1mol,根据反应2Fe3++Cu═2Fe2++Cu2+可知,0.1mol铜完全反应消耗0.2molFe3+;所以乙与盐酸反应生成的为0.2molFe3+、0.15molFe2+,铁的平均化合价为:$\frac{0.2mol×3+0.15mol×2}{0.35mol}$=$\frac{18}{7}$,则乙的化学式为:Fe7O9,
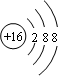
(1)甲为Cu2S,甲中阴离子为硫离子,硫离子结构示意图为: ;32gCu2S的物质的量为:$\frac{32g}{160g/mol}$=0.2mol,浓硝酸足量,Cu元素从+1转化成+2价、硫元素从-2转化成+6价,则反应中失去电子总物质的量为:0.2mol×2×(2-1)+0.2mol×[6-(-2)]=2mol,反应转移电子总数为2NA;
;32gCu2S的物质的量为:$\frac{32g}{160g/mol}$=0.2mol,浓硝酸足量,Cu元素从+1转化成+2价、硫元素从-2转化成+6价,则反应中失去电子总物质的量为:0.2mol×2×(2-1)+0.2mol×[6-(-2)]=2mol,反应转移电子总数为2NA;
故答案为: ;2NA;
;2NA;
(2)根据分析可知,乙的化学式为:Fe7O9;稀硫酸与乙反应的化学方程式为:9H2SO4+Fe7O9=3FeSO4+2Fe2(SO4)3+9H2O,
故答案为:Fe7O9;9H2SO4+Fe7O9=3FeSO4+2Fe2(SO4)3+9H2O;
(3)甲在足量氧气中充分灼烧的气体产物为二氧化硫,将二氧化硫通入一定量A溶液中,该反应的离子方程式:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;该反应后溶液中含有亚铁离子,检验亚铁离子的方法为:取反应后的溶液两份于试管中,向一份中加入酸化的KMnO4溶液,若褪色,则含有+2价铁,向另一份中加入KSCN溶液,若出现血红色溶液,则含有+3价铁,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;取反应后的溶液两份于试管中,向一份中加入酸化的KMnO4溶液,若褪色,则含有+2价铁,向另一份中加入KSCN溶液,若出现血红色溶液,则含有+3价铁.
点评 本题考查了物质推断、性质实验方案的设计、混合物反应的计算,题目难度中等,正确推断甲和乙的化学式为解答关键,注意掌握常见反应化学方程式的书写原则,明确性质实验方案设计的方法,试题培养了学生的分析能力及化学实验能力,题目难度中等.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体 | |
| B. | 焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀硫酸洗净并灼烧 | |
| C. | 中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果 | |
| D. | 移液管取液后,将移液管垂直伸入容器里面,松开食指使溶液全部流出,数秒后,取出移液管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 还原剂在反应中发生还原反应 | |
| C. | 氧化还原反应的本质是电子的转移 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧的摩尔质量是48 g | |
| B. | 1mol臭氧的体积是22.4L | |
| C. | 16 g臭氧中含有6.02×1023个氧原子 | |
| D. | 已知每个氧原子内有8个质子,那么1 mol臭氧中含有3mol质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体区别于非晶体的本质特征是晶体中原子呈周期性有序排列 | |
| B. | 缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为的立方体晶体体现了晶体的自范性 | |
| C. | M为第ⅡA元素,MCO3中M2+半径越大,MCO3热分解温度越低 | |
| D. | 干冰中CO2的配位数12大于冰中H2O的配位数4,是由于丙中水分子之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.96L | B. | 6.72L | C. | 5.6L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| B | 滴加盐酸溶液 | 产生无色无味气体使澄清石灰水变浑浊 | 原溶液中有CO32- |
| C | 滴加硫酸钠和稀硝酸溶液 | 产生白色沉淀 | 原溶液中有Ba2+ |
| D | 滴加稀NaOH溶液 | 生成白色沉淀 | 原溶液中一定有Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4I的电子式: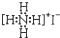 | |
| B. | 填充模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 原子结构示意图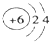 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C | |
| D. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com