
【题目】(1)6.4gM和17.0gN恰好完全反应,生成0.4molX和12.2gY,则X的摩尔质量为:___。
(2)实验室需要制备22.4L(标准状况)H2,现用质量分数为90.0%的锌粒与足量的稀盐酸反应(假设杂质不与稀盐酸反应),问:(要求写出计算过程)
①至少需要质量分数为90.0%的锌粒多少克?___
②生成的氯化锌的物质的量是多少?___
【答案】28g·mol-1 72.2g 1mol
【解析】
(1)先根据质量守恒计算X的质量,再根据M=![]() 计算其摩尔质量。
计算其摩尔质量。
(2)22.4L(标准状况)H2的物质的量为![]() =1mol,根据Zn+2HCl=ZnCl2+H2↑可知,参加反应的Zn的物质的量为1mol,生成ZnCl2的物质的量为1mol。
=1mol,根据Zn+2HCl=ZnCl2+H2↑可知,参加反应的Zn的物质的量为1mol,生成ZnCl2的物质的量为1mol。
(1)6.4gM和17.0gN恰好完全反应,生成0.4molX和12.2gY,根据质量守恒知,X的质量=6.4g+17g-12.2g=11.2g,X的摩尔质量=![]() =
=![]() =28g·mol-1;
=28g·mol-1;
(2)22.4L(标准状况)H2的物质的量为![]() =1mol,根据Zn+2HCl=ZnCl2+H2↑可知,参加反应的Zn的物质的量为1mol,生成ZnCl2的物质的量为1mol;
=1mol,根据Zn+2HCl=ZnCl2+H2↑可知,参加反应的Zn的物质的量为1mol,生成ZnCl2的物质的量为1mol;
①至少需要质量分数为90.0%的锌粒为![]() =72.2g;
=72.2g;
②由分析知生成的氯化锌的物质的量是1mol。


科目:高中化学 来源: 题型:
【题目】现有以下物质:①NaCl固体;②液态CO2;③液态氯化氢;④汞;⑤固体BaSO4;⑥蔗糖;⑦酒精;⑧熔融的Na2CO3,请回答下列问题:
(1)以上物质中能导电的是________;
(2)以上物质属于电解质的是________;
(3)以上物质属于非电解质的是_______;
(4)以上物质溶于水后形成的溶液能导电的是______;
(5)属于盐的有________;
(6)写出⑧溶于水中的电离方程式_____;
(7)分离胶体和溶液常用的方法叫__________;
(8)等质量的O2和O3所含原子个数比为______;
(9)设NA为阿伏加德罗常数的数值,若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________。(用含有NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫代磷酸锌( ![]() )是一种表面活性剂,能够提高橡胶的抓着力、耐磨性。请回答下列问题:
)是一种表面活性剂,能够提高橡胶的抓着力、耐磨性。请回答下列问题:
(1)二硫代磷酸锌结构中,P的杂化方式为__________________,C1、P、S的第一电离能由大到小的顺序为_____________________。
(2)Zn2+的价层电子排布式为________________,锌能够跟强碱溶液反应生成[Zn(OH)4]2-,不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为__________________。
(3)硫元素能形成多种含氧酸,两分子硫酸脱去一分子水生成焦硫酸(H2S2O7),则1mol焦硫酸中含有硫氧键的数目为____________;用价层电子互斥理论判断并解释SO32-与SO42-键角的相对大小。
(4)纤锌矿的六方晶体结构如图所示,该晶胞的化学式为___________,其晶胞参数分别为a pm和b pm,则该晶体的密度为____________________g·cm-3(用含a、b、NA的代数式表示)。
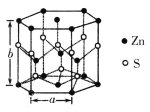
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
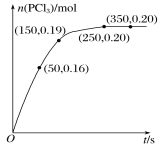
A.反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C.T ℃时,该反应的化学平衡常数K=0.025
D.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,综合利用CO2对构建低碳社会有重要意义。
(1)已知: H2(g)+ ![]() O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+
O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+ ![]() O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
(2)工业生产中可利用H2还原CO2制备清洁能源甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
①保持温度、体积一定,能说明上述反应达到平衡状态的是_________。
A.容器内压强不变 B.3v正 (CH3OH)= v正 (H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
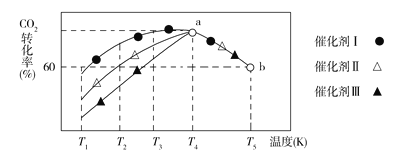
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图所示,催化效果最好的是催化剂________(填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是________。
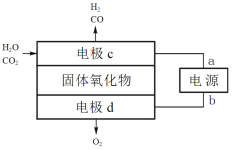
(3)固体氧化物电解池(SOEC)可用于高温电解CO2/H2O,既可高效制备合成气(CO和H2),又可实现CO2的减排,其工作原理如图。
①电源正极为________(填“a”或“b”),电极c上发生的电极反应式为________、_____。
②阴阳两极生成的气体的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH -):a<b
C.相同温度下,电离常数K( HX):a>b
D.![]() =3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
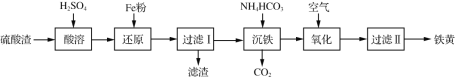
下列说法不正确的是
A. “酸溶”中加热或搅拌或适当增大硫酸浓度均可加快溶解速度
B. 滤渣的主要成分是SiO2和Fe
C. “沉铁”过程中生成Fe(OH)2的化学方程式为: FeSO4+2NH4HCO3===Fe(OH)2↓+ (NH4)2SO4+ 2CO2↑。
D. “氧化”Fe(OH)2浆液时,可用氯气代替空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com