
| A. | 把浑浊的液体倒入蒸发皿中加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 待水分完全蒸干后停止加热 | |
| D. | 蒸干水分后用玻璃棒转移固体至滤纸上 |
分析 粗盐提纯的步骤为:溶解、过滤、蒸发,在开始加热时要不断用玻璃棒搅拌,直到有大量固体出现时停止加热,余热将固体蒸干,最后将蒸干水分后用玻璃棒转移固体至滤纸上,据此进行解答.
解答 解:A.浑浊的液体要过滤后再通过玻璃杯引流到蒸发皿中,故A错误;
B.在开始加热过程中要不断用玻璃棒搅拌,防止溶液溅出,故B错误;
C.蒸发皿中出现大量固体时停止加热,不能完全蒸干,故C错误;
D.当蒸发皿水分蒸干后,用玻璃杯将氯化钠转移到滤纸上,故D正确;
故选D.
点评 本题考查了粗盐的提纯方法,题目难度不大,明确常见化学实验基本操作方法为解答关键,注意掌握粗盐的提纯步骤,试题侧重基础知识的考查,培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
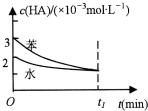 常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )
常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )| A. | HA在水中的电离速率大于其在苯中的双聚速率 | |
| B. | t1时刻在水中和苯中c(A-)相同 | |
| C. | 向上述的混合体系中加入少量水和苯的混合物,则两平衡均正移,c(HA)均减小 | |
| D. | 用10mL 0.05mol•L-1的NaOH溶液可恰好中和混合体系中的HA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
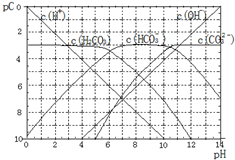
| A. | 某温度下,CO2饱和溶液的浓度是0.05mol•L-1,其中$\frac{1}{5}$的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% | |
| B. | 25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6 | |
| C. | 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO${\;}_{3}^{2-}$)+c(OH-)+c(HCO${\;}_{3}^{-}$) | |
| D. | 25℃时,0.1mol/LNa2CO3中C(HCO${\;}_{3}^{-}$)比0.1mol/LH2CO3中C(HCO${\;}_{3}^{-}$)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔和苯 | B. | 一氧化碳和氢气 | C. | 乙炔和乙烯 | D. | 苯和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应发生的过程中,只放出能量 | |
| B. | 化学反应中的能量通常表现为热量的变化 | |
| C. | 锌与盐酸反应是吸热的过程 | |
| D. | 反应物的总能量高于生成物的总能量为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丙、丁 | C. | 乙、甲、丁、丙 | D. | 丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
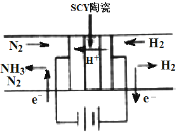 科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )
科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )| A. | 阴极的电极反应是N2+6H++6e-=2NH3 | |
| B. | 阴极材料和阳极材料都可选用铁 | |
| C. | H2在阳极上发生反应是H2-2e-=2H+ | |
| D. | 该过程的总反应式是N2+3H2$\frac{\underline{\;电解\;}}{\;}$2NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com