
 低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
| △c |
| △t |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| △c |
| △t |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c×c |
| (0.02-c)×(0.02-c) |
| 0.015 |
| 0.2 |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
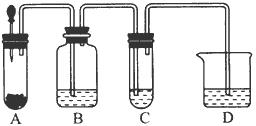 小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)
小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、油脂和蛋白质是基本营养物质 |
| B、蛋白质水解的最终产物是多肽 |
| C、糖尿病人不能食用含糖和淀粉的食品 |
| D、向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷完全燃烧的热化学方程式为C3H8+5O2═3CO2+4H2O△H=-2 036 kJ/mol |
| B、C3H8(g)+5O2(g)═3CO2(g)+4H2O(g);△H<-2 036 kJ/mol |
| C、丙烷完全燃烧的热化学方程式为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=2 036 kJ/mol |
D、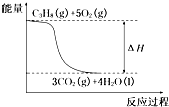 丙烷燃烧的能量变化可用如图所示表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、Cl2既是氧化剂,又是还原剂 |
| B、3 mol氯气参加反应转移5 mol电子 |
| C、氧化产物的物质的量是还原产物的物质的量的5倍 |
| D、每有1 mol原子被氧化的同时就有5 mol原子被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某元素的原子半径是0.160 nm |
| B、某常见气体的密度为1.8 g/cm3 |
| C、某澄清石灰水的浓度是4.0 mol/L |
| D、某溶液中溶质的质量分数120% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| t/s | 0 | 500 | 1 000 |
| c(H2)/(mol?L-1) | 5.00 | 3.52 | 2.48 |
| c (CO)/(mol?L-1) | 2.50 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com