
| A�� | ��һ������t1��ı�����Һ���º���ҺŨ��С��$\frac{{S}_{1}}{100+{S}_{1}}$��100% | |
| B�� | ��t1��ʱ�ı�����Һ���µ�t2�棬�����x���壨S2-S1��g�ű��� | |
| C�� | ��t1���t2��ʱx�����ֱ�����Һ��a g�ֱ�����t�棬������ҺŨ����� | |
| D�� | ��t3��ʱ�ı�����Һ��100+S3��g��ȴ��t2��ʱ��һ���������壨S3-S2��g |
���� A�������¶ȣ���Һ��Ϊδ������Һ��
B��ˮ��������֪���������㣻
C��������Һ��Ũ��ֻ���¶��йأ�
D�������ľ����к��нᾧˮ��
��� �⣺A����һ������t1��ı�����Һ���£������¶ȣ���Һ��Ϊδ������Һ��û������������������ҺŨ�Ȳ��䣬����ҺŨ�ȵ���$\frac{{S}_{1}}{100+{S}_{1}}$��100%����A����
B��ˮ������Խ���γɱ�����Һ��Ҫ������Խ�࣬����ˮ��������֪���������������γɱ�����Һʱ����Ҫ���ʵ���������B����
C����t1���t2��ʱx�����ֱ�����Һ��a g�ֱ�����t�棬��Ȼ�DZ�����Һ���¶���ͬ����Һ��Ũ����ͬ����C��ȷ��
D����t3��ʱ�ı�����Һ��100+S3��g��ȴ��t2��ʱ�����������壬�������ֻ�������ʣ���������Ϊ��S3-S2��g�����������Ĺ����Ǻ��нᾧˮ�����ʣ���������������������ڣ�S3-S2��g����D����
��ѡC��
���� ���⿼�����ܽ�ȡ��¶ȶ��ܽ�ȵ�Ӱ�죬��Ŀ�ѶȲ���ע�ⱥ����Һ���ܽ��ֻ���¶��йأ�����������ѧ���ķ������������������Ӧ�û���֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ��������ȡ�Ҵ�������ˮ�ⷴӦ | |
| B�� | Ϊ��ȥ���е��������ӣ��������м�����������ˮ����� | |
| C�� | �Ҵ��������Ǿ��ܷ���������Ӧ | |
| D�� |  �ĵ����ǣ�CH3-C��C-CH3 ��CH2=CH-CN �ĵ����ǣ�CH3-C��C-CH3 ��CH2=CH-CN |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
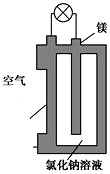 þȼ�ϵ����Ϊһ�ָ��ܻ�ѧ��Դ�����б������ߡ�ʹ�ð�ȫ���㡢�ɱ��͡�ȼ���������ˡ���ȾС���ص㣬ӵ�����õ�Ӧ��ǰ������ͼ��þȼ�ϵ�ص�һ��ԭ��ͼ����װ��ΪԲͲ״��������Ϊþ����ԲͲΪ�����ĵ�����ϣ������йظ�þȼ�ϵ�ص�������ȷ���ǣ�������
þȼ�ϵ����Ϊһ�ָ��ܻ�ѧ��Դ�����б������ߡ�ʹ�ð�ȫ���㡢�ɱ��͡�ȼ���������ˡ���ȾС���ص㣬ӵ�����õ�Ӧ��ǰ������ͼ��þȼ�ϵ�ص�һ��ԭ��ͼ����װ��ΪԲͲ״��������Ϊþ����ԲͲΪ�����ĵ�����ϣ������йظ�þȼ�ϵ�ص�������ȷ���ǣ�������| A�� | �õ�ص��ܷ�ӦΪ2Mg+O2�T2MgO | |
| B�� | ��Ӧ����O2-������������������ | |
| C�� | Cl-������ʧȥ��������Cl2 | |
| D�� | ������ӦʽΪO2+2H2O+4e-�T4OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�4.0g H218O��D2O�Ļ��������������������������Ϊ2NA | |
| B�� | ���³�ѹ�£�0.1mol/L Na2CO3��Һ������CO32-����ĿС��0.1NA | |
| C�� | �ö��Ե缫���CuSO4��Һ������·��ͨ��2NA�����ӣ�����������11.2L���� | |
| D�� | 35��ʱ��1L pH=2�� H2SO4��Һ������H+����Ŀ��1L pH=12��NaOH��Һ��������OH-����Ŀ��Ϊ0.01NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ �� | �� �� | �� �� |
| A | �������Һ�м���ϡH2SO4�����ȼ����ӣ���ȴ���ټ������� Cu��OH��2��Һ�����ȣ� | û��ש��ɫ�������� | ����û��ˮ��������� |
| B | �ֱ����Ũ�ȵ�Na2CO3��Һ�� Na2SO4��Һ�еμӷ�̪�Լ� | Na2CO3��Һ���ɫ��Na2SO4��Һ���������� | �ǽ����ԣ�S��C |
| C | ȡ��ɫ��Һ����ɫ��Ӧ | ��ɫ�ʻ�ɫ | ˵��ԭ��Һ��һ��������Ԫ�� |
| D | ��Ʒ����Һ�еμ�NaClO��Һ��ͨ��SO2���� | Ʒ����Һ����Ϊ��ɫ | ���߾���Ư������ԭ����ͬ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ˮ���ڶ�����ɱ��Ч�������ļ��� | |
| B�� | �й��Ŵ�����������Һ�����������ͭ�������ͭ�� | |
| C�� | ʳ�Ρ�Ư�۾����Խ�ijЩ�����������ﵽ������Ŀ�� | |
| D�� | �����Ѿƺ�ά����C�ȶ���ά���أ�ͨ��������SO2���Է�ֹӪ���ɷֱ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH2�TCHCH2OH �ܷ����ӳɷ�Ӧ��ȡ����Ӧ��������Ӧ�� | |
| B�� | ������ϩ����ѿ�Ǻ͵����ʾ������л��߷��ӻ����� | |
| C�� | CH3CH�TCHCH3����������ԭ����ͬһ��ƽ���� | |
| D�� | �ṹΪ��-CH=CH-CH�TCH-CH�TCH-CH=CH-���ĸ߷��ӻ�����䵥������ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1����2����5����6�� | B�� | ��3����4����5�� | C�� | ��2����3����5����6�� | D�� | ��1����2����3����4����5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 20mL0.1mol/LCH3COONa��Һ�� 10mL0.1mol/LHCl��Һ��Ϻ�����ԣ�������Һ�У�c��CH3COO-����?c��Cl-����c��CH3COOH����?c��H+�� | |
| B�� | 0.1mol/L Na2C2O4��Һ�� 0.1mol/L HCl ��Һ�������ϣ�������Һ�У�2c��C2O42-��+c��HC2O4-��+c��OH-��=c��Na+��+c��H+�� | |
| C�� | �������ʵ�����NaHC2O4��Na2C2O4����Һ�У�2 c��Na+��=3[c��HC2O4-��+c��C2O42-��+c��H2C2O4��] | |
| D�� | ��amol/L��ˮ��0.01mol/L ����������ϣ�����Ӧ��ȫʱ��Һ�� c��NH4+��=c��Cl-������NH3•H2O�ĵ��볣��Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com