


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、CO2气体通入NaAlO2溶液中 |
| B、SO2气体通入BaCl2溶液中 |
| C、CO2气体通入饱和Na2CO3溶液中 |
| D、SO2气体通入Ba(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与甲醇反应比金属钠与水反应更剧烈 |
| B、结合H+的能力CH3O->OH- |
| C、所得到溶液中K=c(CH3O-)×c(CH3OH2+) |
| D、所得到溶液中c(Na+)=c(CH3OH2+)+c(CH3O-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| T | 基态原子的L层上s电子数等于p电子数 |
| X | 基态原子的最外层未成对电子数在该元素所在周期中最多 |
| Y | 基态原子的第一电离能在该元素所在周期中最小 |
| Z | 单质常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3溶于水后能导电,故SO3为电解质 |
| B、强电解质的水溶液中不存在大量溶质分子 |
| C、向NaCN溶液中滴入酚酞试液显红色,则HCN为强酸 |
| D、25℃时,用CH3COOH溶液滴定等浓度NaOH溶液至pH=7,V(CH3COOH)<V(NaOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
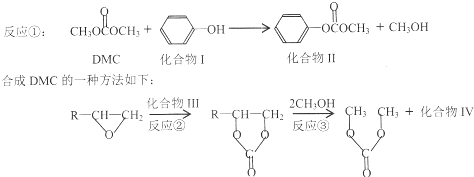
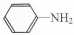 与DMC1:1发生类似反应①的反应,请写出反应方程式
与DMC1:1发生类似反应①的反应,请写出反应方程式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com