
| A. | 可以和碱反应 | B. | 次氯酸具有漂白性 | ||
| C. | 次氯酸不稳定、见光易分解 | D. | 次氯酸钙可和碳酸反应 |
分析 强弱电解质的根本区别是电离程度,完全电离的电解质是强电解质,部分电离的电解质是弱电解质,要想证明次氯酸是弱酸,只要能证明次氯酸部分电离即可,据此分析解答.
解答 解:A.次氯酸可以和碱反应,说明次氯酸属于酸,但不能说明次氯酸部分电离,所以不能证明次氯酸是弱酸,故A错误;
B.次氯酸具有漂白性,是因为其强氧化性性质,与其电离程度大小无关,所以不能证明次氯酸是弱酸,故B错误;
C.次氯酸不稳定、见光易分解,说明次氯酸的稳定性强弱,不能证明次氯酸部分电离,所以不能说明次氯酸是弱酸,故C错误;
D.次氯酸钙能和碳酸反应,根据强酸制取弱酸原理知,次氯酸酸性小于碳酸,碳酸是弱酸,所以次氯酸是弱酸,故D正确;
故选D.
点评 本题考查电解质强弱判断,为高频考点,明确强弱电解质根本区别是解本题关键,电解质强弱与电解质的溶解性、电解质溶液导电性强弱及稳定性等都无关,易错选项是C.


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中查得的相对原子质量为同使素的相对原子质量 | |
| B. | 化学键的变化一定会引起化学反应的变化 | |
| C. | 酸性氧化物一定是非金属氧化物 | |
| D. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
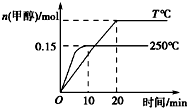 将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,根据图示判断,下列结论正确的是( )
将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,根据图示判断,下列结论正确的是( )| A. | a<0,T<250 | |
| B. | 250℃时,0~10 min内v(H2)=0.015 mol/(L•min) | |
| C. | CO的平衡转化率在250℃时比T℃时大 | |
| D. | 250℃时,起始时向容器中改充1 mol CH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打是面包发酵粉的主要成分之一 | |
| B. | 盐类都可用作调味品 | |
| C. | 铝罐可久盛食醋 | |
| D. | 生石灰用作食品抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性Na>Mg>Al | B. | 氧化性Cl2>S>P | ||
| C. | 酸性H2SO4>H3PO4>HClO4 | D. | 稳定性HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红.
A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com