
| A. | 铁晶须是合金 | B. | 铁晶须不与酸反应 | ||
| C. | 铁晶须可被磁铁吸引 | D. | 铁晶须易溶于水 |
科目:高中化学 来源: 题型:解答题
 ,由其结构可推知硼酸应属于弱酸(选填“弱”或“强”).
,由其结构可推知硼酸应属于弱酸(选填“弱”或“强”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 | 5.4 |
| 完全沉淀 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在BF3、NaCl3分子中,所有原子都满足8电子稳定机构 | |
| B. | P4和CH4空间结构相同,其具有的化学键类型也完全相同 | |
| C. | Cl-的结构示意图可表示为 | |
| D. | COS的电子式可表示为 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
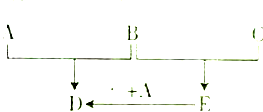 已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):
已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用水煤气合成甲醇是煤液化的一种重要方法,其反应的热化学方程式为CO(g)+2H2(g)?CH3OH(l)△H=-90.8kJ•mol-1,在容积为1L的恒容密闭容器中,充入一定量CO和H2,测得CO和H2的物质的量的变化曲线如图所示.
利用水煤气合成甲醇是煤液化的一种重要方法,其反应的热化学方程式为CO(g)+2H2(g)?CH3OH(l)△H=-90.8kJ•mol-1,在容积为1L的恒容密闭容器中,充入一定量CO和H2,测得CO和H2的物质的量的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
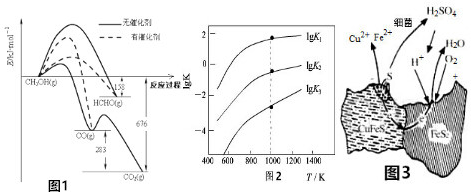
| 相关反应 | 反应热 | 平衡常数K |
| ①FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| ②$\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$FeS(s)+H2S(g) | △H2 | K2 |
| ③FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com