
| A. | 合成氨的反应中,选择“触媒”作催化剂 | |
| B. | 保存浓硝酸时,通常用棕色瓶并放在阴凉处 | |
| C. | 在试管中进行铝和氢氧化钠溶液反应时,稍微加热 | |
| D. | 用纯锌与稀硫酸反应制取氢气时,在溶液中加入少量硫酸铜溶液 |
科目:高中化学 来源: 题型:选择题

| A. | 2Q1+Q2>4Q3 | B. | 2Q1+Q2<4Q3 | C. | Q1+Q2>4Q3 | D. | Q1+$\frac{1}{2}$Q2=2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将表面变暗的金属钠粒投入干燥氯气中,无明显现象 | |
| B. | 将在空气中点燃的金属钠伸入干燥氯气中会继续燃烧,产生黄色火焰和大量黄烟 | |
| C. | 将SO2气体通入溴水中使溴水褪色,滴加BaCl2溶液有白色沉淀产生 | |
| D. | SO2气体通入品红溶液中,品红褪色,加热所得无色溶液红色复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Mg2+ | Fe2+ | Fe3+ |
| 开始沉淀 | 9.1 | 7.6 | 1.9 |
| 完全沉淀 | 11.1 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向纯水中加入少量固体碳酸钠,c(H+)减小,Kw不变,促进水的电离 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,变小 | |
| C. | 将纯水加热到95℃时,变大,pH不变,水仍呈中性 | |
| D. | 向水中加入A1C13固体,平衡正向移动,c(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
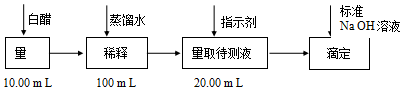
| 实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
| A | B | 消耗体积(mL) | ||
| 1 | 20.00 | 22.05 | ||
| 2 | 20.00 | 21.34 | ||
| 3 | 20.00 | 21.30 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | (1)(2)(3)(4) | C. | (1)(2)(3) | D. | (2)(3)(4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com