
【题目】近年我省汽车拥有量呈较快增长趋势。汽车尾气已成为主要的空气污染物;部分大城市交通干道的NOx和CO严重超过国家标准,已具有发生光化学烟雾污染的潜在危险。
(1)某研究性学习小组在一烟雾实验箱中对光化学烟雾形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化,记录于下图。根据图中数据,下列推论中,最不合理的是_____________
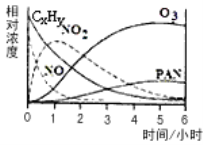
A.NO的消失的速率比CxHy快 B.NO生成NO2
C.CxHy及NO2可以生成PAN及O3 D.O3生成PAN
(2)汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。

①上图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g) 2NO(g)为___________(填“吸热”或“放热”)反应。
②2000℃时,向容积为2L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则2000℃时该反应的平衡常数K=____________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为_______________。
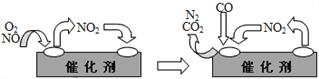
③为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。 写出上述变化中的总化学反应方程式:________________________。
(3)当采用稀薄燃烧[指汽油在较大空/燃比(空气与汽油的体积比)条件下的燃烧]发动机时,此时汽车排除尾气中的主要污染物为NOx。为减少NOx的排放,采用了吸附-还原型催化剂,用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H1=-574 kJ/mol
CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g); △H2
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2=____________。
【答案】 D 吸热 ![]() 或0.11 1/7或14.3% 2NO+O2+4CO
或0.11 1/7或14.3% 2NO+O2+4CO![]() 4CO2+N2 -1160kJmol-1
4CO2+N2 -1160kJmol-1
【解析】(1)A、由曲线斜率可知在某一时间段内NO消失的速率比CxHy快,故A正确;B、NO的浓度一直在减少,NO2的浓度先增加后减少,在0-1时间段内NO可能生成NO2,故B正确;C、图中O3和PAN的浓度增加,CxHy的浓度减少,CxHy及NO2在某一时间段内可能反应生成PAN和O3,故C正确;D、O3的浓度一直在增加,不可能作为反应物,故D错误;故选D;
(2)①根据图象判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应,故答案为:吸热
②利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,
N2(g)+O2(g)2NO(g),
起始(mol/L):5 2.5 0
反应(mol/L):0.5 0.5 1
平衡(mol/L):4.5 2 1
所以平衡常数k= =
=![]() =
=![]() ;
;
令N2转化的物质的量为xmol,则
N2(g)+O2(g)2NO(g),
起始(mol): 1 1 0
反应(mol): x x 2x
平衡(mol):1-x 1-x 2x
所以平衡常数k= =
= =
=![]() ;解得x=
;解得x=![]() ,N2的转化率为
,N2的转化率为![]() ×100%=14.3%,故答案为:
×100%=14.3%,故答案为: ![]() ;14.3%
;14.3%
③NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,反应方程式为2NO+O2+4CO![]() 4CO2+N2,故答案为:2NO+O2+4CO
4CO2+N2,故答案为:2NO+O2+4CO![]() 4CO2+N2;
4CO2+N2;
(3)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJmol-1,②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2,将两个方程式相加:
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-574kJmol-1+△H2
2mol -574kJmol-1+△H2
1mol 867kJmol-1
则: ![]() =
=![]() ,△H2=-1160kJmol-1,故答案为:-1160kJmol-1。
,△H2=-1160kJmol-1,故答案为:-1160kJmol-1。


科目:高中化学 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料,如图是某化工厂对海水资源综合利用的示意图: 
试回答下列问题:
(1)实验室里将粗盐制成精盐的过程中,过滤的操作需用到玻璃棒,玻璃棒的作用是: , 还需要的玻璃仪器有: .
(2)粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中:①加入过量的BaC12溶液,②过量的NaOH溶液,③过量的Na2CO3溶液,则添加试剂顺序为(填写序号),最后在滤液加入盐酸至溶液呈中性.请写出加入盐酸后可能发生反应的离子方程式: .
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度考虑,在母液里加入石灰乳发生反应的离子方程式: .
(4)电解无水氯化镁制取镁的化学方程式为 . 将镁蒸气冷却后即为固体镁,镁蒸气需在Ar气氛围中冷却,理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 棉花和尼龙的主要成分均为纤维素
B. 医用消毒酒精中乙醇的浓度为95 %
C. 可用灼烧的方法区别羊毛和棉线
D. 实验室用酒精作燃料是因为其含碳量高,放热多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝锂合金、碳纤维陶瓷复合材料广泛应用于我国自主研发的C919 大型民用客机。下列有关说法中正确的是( )
A. 合金中不可能含有非金属元素
B. 碳纤维陶瓷复合材料中碳纤维是基体
C. 碳纤维陶瓷复合材料属于高分子有机合成材料
D. 铝锂合金具有质量轻、强度高等优异性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】左啡诺(F)是一种镇痛药,其合成路线如下:

(1)E 中的官能团包含酰胺键、______和_____。
(2)D→E的反应类型为_____。
(3)X 的分子式为C3H3NO2,写出X的结构简式: _____。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式: _____。
①含有苯环,苯环上的一溴代物有两种,分子中含有4 种化学环境不同的氢;
②既能发生银镜反应,也能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应。
(5)已知:RCH2Br![]() RCH2CN(R代表烃基)。请写出以
RCH2CN(R代表烃基)。请写出以![]() 和CH3COCl为原料制备
和CH3COCl为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用碱式碳酸铜[CuCO3·Cu(OH)2]制取铜粉并测定铜粉纯度的实验如下:
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I-![]() CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步骤1中所发生反应的化学方程式为_________________。
(2)步骤2 中所发生反应的离子方程式为_________________。
(3)步骤3 中加入过量KI的作用是_________________。
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示酶和催化剂改变化学反应速率的原理,图2表示加入抑制剂对起始反应速率的影响。酶的抑制剂是与酶结合并降低酶活性的分子。竞争性抑制剂与底物竞争酶的活性部位,非竞争性抑制剂和酶活性部位以外的其他位点结合,从而抑制酶的活性。请回答下列问题。
 图1
图1 图2
图2
(1)由图1可知,该酶降低的活化能是______(用图中字母表示),与无机催化剂相比______________________,因而催化效率更高。
(2)活细胞产生酶的场所有________,需要的原料是________。
(3)图2中对照组是____曲线的结果,其中b为加入_____抑制剂的曲线,判断理由是_________________。请在图2中画出加入该酶的激活剂的曲线。________________
(4)信号肽假说认为,编码分泌蛋白的mRNA在翻译时首先合成的是N末端带有疏水氨基酸残基的信号肽,它被内质网膜上的受体识别并与之相结合。信号肽经由膜中蛋白质形成的孔道到达内质网内腔,但蛋白质转到高尔基体加工时却没有了该信号肽序列。据此我们可以推断内质网中可能存在的酶及作用是_______________。
(5)蛙的红细胞合成酶所需要的ATP主要由_______(过程)产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途都正确且具有对应关系的是( )
A.ClO2具有强氧化性,可用于水消毒剂
B.石英熔点高,可用于制造石英研钵
C.氢氧化铝受热易分解,可用作胃酸中和剂
D.生石灰能与水反应,可用于干燥氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( ) 
A.若D为白色沉淀,且与A的摩尔质量相等,则X一定是铝盐
B.若A是单质,B和D的反应是OH﹣+HCO3﹣═H2O+CO32﹣ , 则E一定能还原CuO
C.若B、X均为单质,D为CO,C能和E反应,则E为NaOH
D.若X是Na2SO3 , C是能使品红溶液褪色的气体,则A可能是氯气,且D和E不反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com