
| 物质 | CH4 | CH3OH(l) | CH3CH2OH(l) | CO(g) | H2(g) |
| 燃烧热△H/kJ?mol-1 | -890.31 | -726.51 | -1366.8 | -283 | -285.8 |
| A、-247.3kJ?mol-1 |
| B、+247.3kJ?mol-1 |
| C、+321.5kJ?mol-1 |
| D、-321.5kJ?mol-1 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、H2O2+H2SO4=SO2↑+O2↑+2 H2O |
| B、2I-+2Fe3+=I2+2 Fe2+ |
| C、2Fe3++SO2+2 H2O=2Fe2++SO42-+4H+ |
| D、SO2+2 H2O+I2=H2SO4+2HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
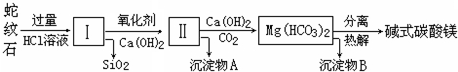
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
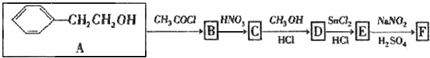
| HCl |

查看答案和解析>>
科目:高中化学 来源: 题型:
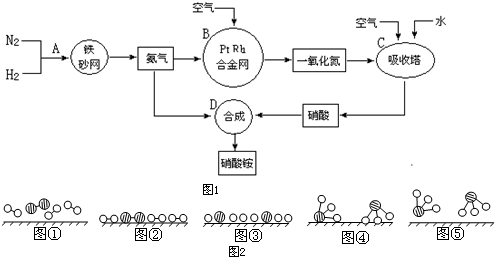
 分别表示N2、H2、NH3.
分别表示N2、H2、NH3.
| ||
| △ |
| 注意事项 | 理由 | |
| ① | ||
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取5.00mL 1.00mol?L-1盐酸于50mL容量瓶中,加水稀释至刻度可配制0.100mol?L-1盐酸 |
| B、用10mL的量筒准确量取9.50mL水 |
| C、向碘水中加入CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| D、稀释浓硫酸时将水倒入浓硫酸中进行搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
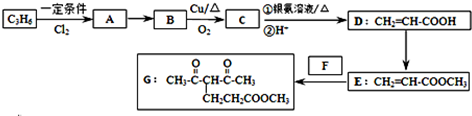
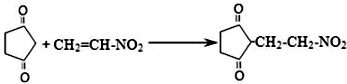
查看答案和解析>>
科目:高中化学 来源: 题型:
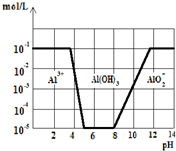 常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标
常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标| A、从图中数据计算可得Al(OH)3的溶度积Ksp=10-23 |
| B、沉淀Al3+可以控制溶液pH的范围为5~8 |
| C、向KAl(SO4)2溶液中加入KOH固体至pH=7时,c(K+):c(SO42-)=2:1 |
| D、往KAl(SO4)2溶液中加入足量的氢氧化钾溶液,反应的离子方程式可表示为:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用溴水可以鉴别乙醇、苯和四氯化碳 |
| B、乙酸乙酯中的少量乙酸可以用氢氧化钠溶液除去 |
| C、用新制氢氧化铜悬浊液可以检验尿液中是否含有葡萄糖 |
| D、用酸性高锰酸钾溶液可以区分乙烷和乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com