
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是?????????????? ,属于????? 区元素,它的外围电子的电子排布图为??????????????????????????????? 。

(2)XZ2分子的立体结构是?????????????? ,YZ2分子中Y的杂化轨道类型为????????? ,相同条件下两者在水中的溶解度较大的是?????????????????????????? (写分子式),理由是????????????????????????????????????????????????????????????????????? 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 ?????? 。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。
(1)?? 第三周期ⅥA族(1分)p(1分)???? 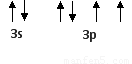 ?????? (1分)
?????? (1分)
(2)V形(1分)sp型杂化(1分)?? SO2 (2分) SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大。(2分)
(3)紫2分 电子由较高能级跃迁到较低能级时,以光的形式释放能量。(2分)
(4)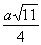 (2分)
(2分)
【解析】
试题分析: X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,应为C元素,Z是地壳内含量最高的元素,为O元素,M的内层电子数是最外层电子数的9倍,为Ca元素,N的原子序数比M小1,为K元素, Q在元素周期表的各元素中电负性最大,应为F元素。(1)由以上分析可知,X为S,在周期表的位置是第三周期ⅥA族,属于p区元素;(2)XZ2分子是SO2中,S和O形成2个δ键,有1个孤电子对,为V形,YZ2分子是CO2,C和O形成2个δ键,没有孤电子对,为直线形,sp型杂化;(3)N为K,焰色反应为紫色,电子由较高能级跃迁到较低能级时,以光的形式释放能量,所以呈现不同的焰色;4)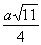
考点:考查物质结构与性质、晶包的计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:



 或
或
 或
或

 4Al+3O2↑
4Al+3O2↑ 4Al+3O2↑
4Al+3O2↑查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
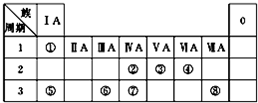 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| Ⅰ | 酸性 | |
| Ⅱ | 还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com