
【题目】H2S是一种剧毒气体,对H2S废气资源化利用的途径之一是回收能量并得到单质硫。如图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
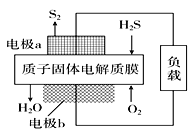
A. 电极a发生还原反应
B. 当电路中通过4 mol电子时,有4molH+经质子膜进入负极区
C. 电池总反应为:2H2S+3O2 =2SO2+2H2O
D. 电极b的电极反应式为:O2+4e-+4H+=2H2O
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置研究SO2的性质:
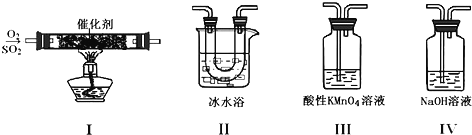
已知:
物质 | 熔点℃ | 沸点℃ |
SO2 | -76.1 | -10 |
SO3 | 16.8 | 45 |
(1)装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式________________。
(2)甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是___;观察到装置Ⅲ中现象是________________,说明二氧化硫具有___性
(3)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40mL2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的总的化学方程式是___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下反应中的四种物质由三种元素组成,其中a的分子立体构型为正四面体形,组成a物质的两种元素的原子序数之和小于10,组成b物质的元素为第三周期元素。下列判断正确的是
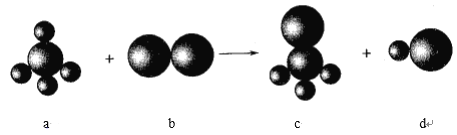
A. 四种分子中的化学键均是极性键
B. a、c分子中中心原子均采用sp3杂化
C. 四种分子中既有σ键,又有π键
D. b、d分子中共价键的键能:b>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释工业生产或应用的化学用语中,不正确的是( )
A. FeCl3溶液刻蚀铜电路板:2Fe3+ + Cu==2Fe2++ Cu2+
B. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O== Al(OH)3↓ + 3NH4 +
C. 将少量二氧化碳通入次氯酸钠溶液中:CO2+H2O+2ClO-== CO32-+2HClO
D. Na2CO3溶液处理水垢:CaSO4(s)+CO32(aq)![]() CaCO3(s)+SO42(aq)
CaCO3(s)+SO42(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
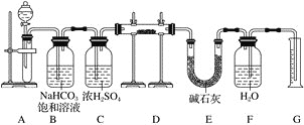
回答下列问题:
(1)装置A中液体试剂选用________________。
(2)装置B的作用是_________。装置E中碱石灰的作用是________。
(3)装置D中发生反应的化学方程式是__________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有___________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80℃,目的是___________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期过渡元素单质及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态Cu原子电子排布式为:__________。
(2)过渡金属单质及化合物是有机合成反应的重要催化剂。
例如: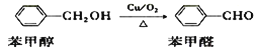
①苯甲醇中碳原子的杂化类型是___________。
②苯甲醇的沸点比苯甲醛_______ 。(填“高”或“低”)
③苯甲醛分子中三种非金属元素C、O、H的电负性由大到小的顺序是____________ 。
(3)多数过渡金属的配离子在水中有颜色,其显色与配合物分裂能有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,用![]() 表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,
表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,![]() 越大。分裂能(
越大。分裂能(![]() )Co(H2O)62+_______Co(H2O)63+(填“ > ”“〈”或“ =”)。
)Co(H2O)62+_______Co(H2O)63+(填“ > ”“〈”或“ =”)。
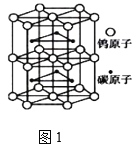
(4)钨与碳组成一种特殊材料,其晶体的晶胞如图1所示,它的熔点为2870℃、硬度类似金刚石,预测它的晶体类型是_________。
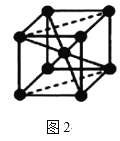
(5)Fe的一种晶体如图2所示,设阿伏加德罗常数的值为NA,铁原子的半径是r cm,该晶体的密度是ρ g/cm3,则铁的相对原子质量为___(只列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH===NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(夹持固定装置已略去)。

请回答下列问题:
(1)E装置中制取NO2的化学方程式是_____________________________。
(2)若NO2能被NH3还原,预期观察到C装置中的现象是________________。
(3)此实验装置存在的一个明显缺陷是_______________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(4)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:________________________________________________。
(5)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。

①装置的合理连接顺序是(某些装置可以重复使用)_________________。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com