
| A. | 溶液pH由大变小 | B. | 负极附近Zn2+浓度逐渐增大 | ||
| C. | H+向负极移动 | D. | 溶液中H2SO4的浓度不变 |
分析 锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应:Zn-2e-═Zn2+;铜作正极,正极上氢离子得电子发生还原反应电极方程式为2H++2e-=H2↑;电子从负极沿导线流向正极.
解答 解:A、铜作正极,正极上氢离子得电子生成氢气,所以溶液中H+的物质的量不断减小,pH增大,故A错误;
B、锌作负极,负极上锌失电子生成锌离子,锌离子浓度增大,故B正确;
C、原电池中阴离子移向负极,阳离子移向正极,氢离子移向正极,故C错误;
D、正极上氢离子得电子发生还原反应电极方程式为2H++2e-=H2↑,硫酸浓度减小,故D错误;
故选B.
点评 本题考查了原电池原理,难度不大,注意把握正负极的判断和电极方程式的书写以及离子的移动方向.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A的初$\frac{始浓度}{mol•{L}^{-1}}$ | B的初$\frac{始浓度}{mol•{L}^{-1}}$ | 生成C的$\frac{初始速率}{mol•{L}^{-1}•{s}^{-1}}$ |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极 | B. | 负极反应式:O2+4H++4e-→2H2O | ||
| C. | 正极发生氧化反应 | D. | 电解液肯定不是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
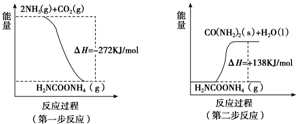
 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和(CuSO4) |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molH2SO4 | B. | 0.2molH2SO3 | C. | 0.2molSO3 | D. | 0.3molCO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com