
| A. |  该反应过程中的能量变化如图所示 | |
| B. | 该反应条件下,Al的还原性强于Fe | |
| C. | 反应中每生成1 mol Fe转移6×6.02×1023个电子 | |
| D. | 实验室进行该反应时常加入KClO3作催化剂 |
分析 A.铝热反应属于放热反应;
B.氧化还原反应中还原剂的还原性大于还原产物的还原性;
C.反应中Fe元素的化合价从+3价降低到0价;
D.铝热反应中氯酸钾受热分解生成氧气.
解答 解:A.铝热反应属于放热反应,反应物的总能量大于生成物的总能量,图象不符,故A错误;
B.Al和Fe2O3反应生成Fe和Al2O3,Al作还原剂,Fe是还原产物,所以Al的还原性强于Fe,故B正确;
C.反应中Fe元素的化合价从+3价降低到0价,所以反应中每生成1 mol Fe转移3×6.02×1023个电子,故C错误;
D.铝热反应中氯酸钾受热分解生成氧气,反应中KClO3不是催化剂,故D错误.
故选B.
点评 本题考查了铝热反应、氧化还原反应,题目难度不大,明确铝热反应中各物质的作用及反应现象以及氧化还原反应原理是解题的关键,注意从化合价的角度分析氧化还原反应.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2通过Na2O2使其增重28 g 时,反应中转移的电子数为0.5NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则 Ba SO4饱和溶液中Ba2+数目为=1×10-5 NA | |
| C. | 标准状况下,22.4 L CH2Cl2中共价键的数目为4NA | |
| D. | 高温下,16.8g Fe与足量的水蒸气完全反应失去电子的数目为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.01 mol•L-1的碳酸钠溶液 | B. | pH=12的Ba(OH)2溶液中 | ||
| C. | 0.01 mol•L-1的醋酸 | D. | 0.01 mol•L-1的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(SO3 )=v(NO2) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 每消耗1 mol SO3的同时生成1 mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| D | 证明氯化银的溶解度大于硫化银的溶解度 | 向2mL0.1mol•L-1硝酸银溶液中加入1mL0.1mol•L-1NaC1溶液,出现白色沉淀,再加入几滴0.1mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量NaOH溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 通入过量SO2:Fe2+、H+、SO32-、SO42- | |
| D. | 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 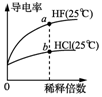 由图可知,a点Kw的数值比b点Kw的数值大 | |
| B. | 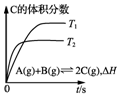 表示在相同的密闭容器中,不同温度下的反应,该反应的△H<0 | |
| C. | 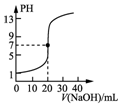 表示0.100 0 mol•L-1 NaOH溶液滴定20.00 mL 0.100 0 mol•L-1醋酸溶液的滴定曲线 | |
| D. |  表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(A)>ω(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
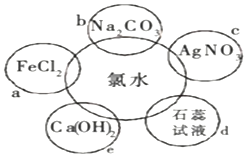 完成下列题目
完成下列题目查看答案和解析>>
科目:高中化学 来源: 题型:选择题
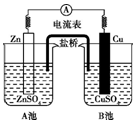
| A. | 电子由Zn极流向Cu极 | B. | 此装置能将电能转变为化学能 | ||
| C. | 取出盐桥,电流表指针不再偏转 | D. | 该装置的总反应:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com