

分析 (1)黄铜矿与空气反应生成Cu和Fe的低价硫化物二氧化硫:产物为Cu2S、FeS、SO2;SO2能够被溴氧化为硫酸;聚硅酸铁净水是利用其吸附作用;
(2)Cu2S被氧化为Cu2O:2Cu2S+3O2 $\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2;2Cu2O+Cu2S $\frac{\underline{\;高温\;}}{\;}$6Cu+2SO2↑,据含铜量相同计算;
(3)电解精炼铜时,粗铜作阳极,该电极上Zn、Fe、Ni、Cu失电子,精铜作阴极,该极上是铜离子得电子,阳极上铜以及比铜活泼的金属会溶解,而没有铜活泼的金属会从阳极掉落下,形成阳极泥.
解答 解:(1)黄铜矿与空气反应生成Cu2S、FeS、SO2,根据化合价升降相等配平,反应方程式为:2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S+2FeS+SO2;SO2能够被溴氧化为硫酸,反应方程式为:SO2+Br2+2H2O=H2SO4+2HBr;聚硅酸铁净水是利用其吸附作用,铝离子和铁离子能够水解产生胶体,能够通过吸附净水,硫酸镁不具备该性质,
故答案为:2CuFeS2+O2$\frac{\underline{\;高温\;}}{\;}$Cu2S+2FeS+SO2;SO2+Br2+2H2O=H2SO4+2HBr;b;
(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2 $\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S $\frac{\underline{\;高温\;}}{\;}$6Cu+2SO2↑,总方程式为:3Cu2S+3O2$\frac{\underline{\;高温\;}}{\;}$6Cu+3SO2,
含铜量相同时,设需要CuFeS2的质量为xt,则有40%xt×$\frac{M(Cu)}{M(CuFe{S}_{2})}$×100%=2t×98%,x=4.9t,
故答案为:3Cu2S+3O2$\frac{\underline{\;高温\;}}{\;}$6Cu+3SO2;4.9;
(3)a、电解池中,电能不会全部转化为化学能,还会伴随热能等形式的能的产生,故a错误;
b、电解精炼铜时,粗铜作阳极,接电源正极,发生氧化反应,故b正确;
c、溶液中Cu2+向阴极移动,在阴极上发生还原反应,故c错误;
d、在阳极上,没有铜活泼的金属Ag、Pt、Au等金属会从阳极掉落下,形成阳极泥,利用阳极泥可回收Ag、Pt、Au等金属,故d正确;
故答案为:bd.
点评 本题考查铜及其化合物的性质、电解精炼铜的工作原理,特别是考查了学生阅读信息、处理信息的能力,难度稍大.


科目:高中化学 来源: 题型:选择题
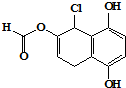
| A. | 不能发生银镜发应 | |
| B. | 1mol 该物质最多可与2molBr2反应 | |
| C. | 1mol 该物质最多可与4mol NaOH反应 | |
| D. | 与NaHCO3、Na2CO3均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后pH=7,则消耗溶液的体积:②>③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最小 | |
| D. | 向溶液中加水稀释到原来的10倍,溶液的pH:④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-只向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-=Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| C. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应物 | 反应条件1 | 反应条件2 | |
| A | CH3CHICH3 | NaOH的水溶液,加热 | NaOH的乙醇溶液,加热 |
| B | 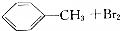 | 光照 | 铁粉 |
| C | 乙醇+氧 | 点燃 | Cu做催化剂,加热 |
| D | 乙烯 | 溴水 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 0.1mol•L-1Na2S溶液中所含S2-总数小于0.1NA | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
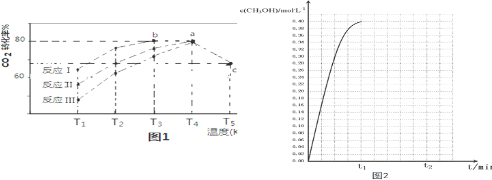
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.007 0 mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com