
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |
分析 A.容量瓶中不能溶解固体;
B.量筒的规格应与液体体积接近,减小误差;
C.托盘天平的感量为0.1g;
D.分液漏斗用于分层的液体混合物分离.
解答 解:A.容量瓶中不能溶解固体,应在烧杯中溶解、冷却后转移到容量瓶中定容,故A错误;
B.量筒的规格应与液体体积接近,减小误差,则应选10mL量筒量取5.2mL的盐酸,故B错误;
C.托盘天平的感量为0.1g,则用托盘天平称取25.2gNaCl,故C正确;
D.分液漏斗用于分层的液体混合物分离,应选漏斗过滤NaCl溶液中泥沙,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、仪器的实验、混合物分离为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热△H | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和NH3•H2O反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+2×283.0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
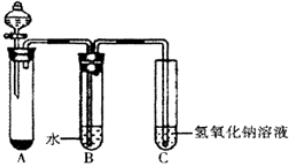
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (Q1+Q2+Q3) kJ | B. | 0.5(Q+Q2+Q3) kJ | ||
| C. | (0.5Q1-1.5Q2+0.5Q3) kJ | D. | -(3Q1-Q2+Q3) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.9 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=1.4 mol/(L•s) | D. | v(D)=1.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3在反应中得到电子 | |
| B. | ClO2中氯的化合价为+4价 | |
| C. | 在反应中H2C2O4是还原剂 | |
| D. | 1 mol KClO3参加反应有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
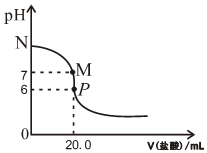 298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.
298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 | |
| B. | 步骤①中当溶液呈现深黄色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O 达到平衡状态 | |
| C. | 步骤②中,若要还原1 mol Cr2O${\;}_{7}^{2-}$离子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com