
| 1.6 |
| 0.4+0.6+1.6+3.5 |
| 162g |
| 6.1mol |


科目:高中化学 来源: 题型:
| A、3:1 | B、2:l |
| C、1:1 | D、缺少条件,无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②⑤ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离产生的c(OH-)=10-12mol?L-1 | ||
| B、向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) | ||
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和等物质的量的HCl | ||
D、用水稀释时,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小 |
| B、若根据反应“H2+Cl2=2HCl”设计成燃料电池,既可发电同时还可用于制备盐酸 |
| C、可逆反应的正、逆反应平衡常数数值互为倒数 |
| D、电镀铜时,纯铜或石墨做阳极,电镀液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、D的质量不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率υA:υB:υC:υD=m:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
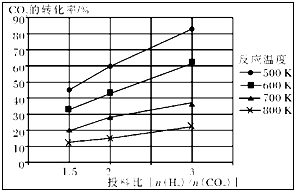
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示.则下列说法中正确的是( )| A、a点时溶液中所含主要溶质为(NH4)2SO4 |
| B、a→b段发生反应的离子方程式是:SO42-+Ba2+=BaSO4↓ |
| C、b点为最大沉淀量,对应的纵坐标值为0.2 |
| D、c点加入Ba(OH)2溶液的体积为200 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com