
【题目】某兴趣小组利用反应Zn+2FeCl3=ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是
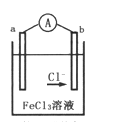
A. Zn为负极,发生还原反应
B. a电极反应式为Zn-2e—=Zn2+
C. 电子流动方向是a电极![]() FeCl3溶液
FeCl3溶液![]() b电极
b电极
D. 电池的正极材料可以选用石墨、铂电极,也可以用铜电极
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)①1H、2H、3H ②O2和O3 ③12CO2和14CO2 ④金刚石和石墨
同位素的是;同种物质的是;同素异形体的是(填序号).
(2)写出NaHSO4溶液与NaOH溶液反应的离子方程式 .
(3)淡黄色的固体甲可作供氧剂,写出固体甲的电子式 , 固体甲与水的离子方程式 , 0.5mol的固体甲与CO2反应转移的电子数目 .
(4)实验室制备氯气的方法:(写化学方程式),氯气与湿润的Na2CO3反应可制备Cl2O,其化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空 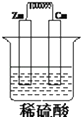
(1)锌为:极(填“正”或“负”)电极反应式为: ,
(2)反应过程中电流的方向为:
A 由铜流向锌 B 由锌流向铜
(3)若有锌片质量减少了0.65g,则转移了mol电子发生转移,铜片上产生气体的体积(标况下)为:L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃0.5 mol能与1 molHCl完全加成,加成后的产物分子上的氢原子又可被2 molCl2完全取代。则此气态烃可能是( )
A. HC≡CH B. CH2=CH2
C. HC≡C-CH3 D. CH2=C(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键键能如下。
化学键 | C—H | C=C | C—C | H—H |
键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热___________________________
(2)已知H2(g)+Br2(l)=2HBr(g);ΔH=-72 kJ/mol。蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
则表中a为__________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应
2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH=________。
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
(4)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________________________________________________________。
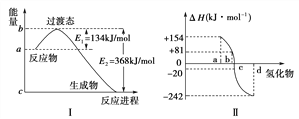
(5)图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲(Te)在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢发生分解反应的热化学方程式:_____________________。
(6)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式:__________________________。
(7) 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。热化学方程式为:N2H4(l) + 2H2O2(l) == N2(g) + 4 H2O(g) △ H=-644.25 kJ/molspan>。又已知H2O (l) == H2O (g) ΔH=+ 44 kJ/mol。则64g液态肼
与液态双氧水反应生成液态水时放出的热量是 _________________ kJ。
(8)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用右图所示电解装置吸收和转化SO2 (A,B均为惰性电极)。下列说法正确的是

A. B电极为电解池的阴极
B. B极区吸收5mo1 SO2,则A极区生成2.5 mo1 S2O42-
C. B极区电解液为稀硫酸,电解一段时间后硫酸浓度增大
D. A电极的电极反应为:2SO32--2e-+4H+=S2O42- + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于吸热反应的是:①液态水汽化;②将胆矾加热变为白色粉末;③浓硫酸稀释;④氯酸钾分解制氧气;⑤生石灰跟水反应生成熟石灰( )
A.①④⑤B.②④C.②③D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 凡是放热反应都是自发的,凡是吸热反应都是非自发的
B. 自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应
C. 自发反应在恰当条件下才能实现
D. 自发反应在任何条件下都能实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com