
分析 (1)沙子不溶于水;
(2)可用蒸发的方法从溶液中获得晶体;
(3)水和汽油的混合物分层;
(4)溴易溶于有机溶剂;
(5)酒精和水的沸点不同;
(6)胶体不能透过半透膜,离子、分子可以.
解答 解:(1)沙子不溶于水,则选择过滤法分离饱和食盐水和沙子的混合物,故答案为:G;
(2)可用蒸发的方法从溶液中获得晶体,故答案为:C;
(3)水和汽油的混合物分层,水和汽油的混合物分层,则选择分液法分离,故答案为:D;
(4)溴易溶于有机溶剂,可用萃取的方法分离,故答案为:A;
(5)酒精和水的沸点不同,可用蒸馏的方法分离,故答案为:F;
(6)胶体不能透过半透膜,离子、分子可以,可用渗析的方法分离,故答案为:E.
点评 本题考查混合物分离提纯实验,为高频考点,侧重于学生的分析能力和实验能力的考查,注意分离原理及混合物分离方法的选择为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”).
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”).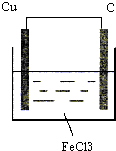 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
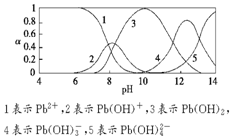 水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示.
水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰水与盐酸的反应 OH-+H+═H2O | |
| B. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于醋酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减小 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 醋酸的电离常数K随醋酸浓度减小而减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com