
【题目】下列各组物质的燃烧热相等的是
A.碳和一氧化碳 B.1 mol碳和2 mol碳 C.3 mol乙烯和苯 D.淀粉和纤维素
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧(O3)生成,下列说法中正确的是
A.O2和O3互为同素异形体
B.O3是由3个氧原子构成的化合物
C.O2和O3相互转化属于化学变化
D.等质量的O2和O3含有的氧原子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.石油的催化重整是获得芳香烃的主要途径
B.煤焦油中含有苯、二甲苯等化工原料
C.天然气和可燃冰的主要成分都是甲烷
D.石油裂解的主要目的是为了得到更多的汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取CoC12·6H2O粗品的工艺流程图如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、A13+等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
请回答下列问题:
(1)上述工艺流程图中操作a的名称:_______________。
(2)写出“浸出”时Co2O3发生反应的离子方程式:____________________。
(3)加入NaC1O3的作用是________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。使用萃取剂最适宜的pH范围是_________(填字母序号)。
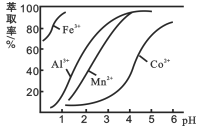
A.2.0~2.5 B. 3.0~3.5 C. 5.0~5.5 D. 9.5~9.8
(5)“除钙”“镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11, Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸与二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。先将一定量的二氧化锰溶解在200mL浓盐酸中,当反应生成8.96L(标况下)Cl2时,测得剩余溶液中盐酸的浓度为2mol/L(假设反应前后溶液的体积不变)。回答下列问题:
MnCl2+Cl2↑+2H2O。先将一定量的二氧化锰溶解在200mL浓盐酸中,当反应生成8.96L(标况下)Cl2时,测得剩余溶液中盐酸的浓度为2mol/L(假设反应前后溶液的体积不变)。回答下列问题:
(1)盐酸在反应中表现出的性质为___________________。
(2)写出上述制取Cl2的离子方程式:______________________________ 。
(3)计算反应耗用MnO2的质量为_________g,被氧化的HCl的物质的量为______ mol,起始HCl的物质的量浓度为____________mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北宋沈括的《梦溪笔谈》对指南针已有详细记载:“方家以磁石磨针锋,则能指南。”磁石的主要成分是
A. Fe3O4 B. Fe2O3 C. FeO D. CuFeS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。

(1)图中甲池是________装置(填“电解池”或“原电池”),其中OH-移向________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: _______________________。
(3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的反应式:______________。
(4)乙池中总反应的离子方程式:____________。
(5)常温下,当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是________(若此时乙池中溶液的体积为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学,为测定某铝镁合金(不含其他元素)中镁的质量分数,设计下列不同实验方案进行探究。填写下列空白。

探究一
实验方案:铝镁合金加入某溶液,测定剩余固体质量(实验装置如图所示)。用单线桥表示出所发生反应的电子转移情况
(1)_________________________________________________。
(2)实验前,先将镁铝合金在稀酸中浸泡片刻,其目的是_____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是___(填序号);记录C的液面位置时,除视线平视外,还应________________。
(4)称取铝镁合金粉末样品m g于B中,向A中加入上述某溶液,反应后测得生成气体体积标况下为VmL,则镁的质量分数为________________。
探究二
实验方案:铝镁合金![]() 测定生成气体的体积(实验装置如图所示),问题讨论:
测定生成气体的体积(实验装置如图所示),问题讨论:

(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是________(填“需要”或“不需要”)。为什么?_________________________
(2)现取镁铝合金粉末0.78g,完全反应后生成的气体的体积在标况下为896mL,则合金粉末中铝的物质的量为________,镁的质量分数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com