

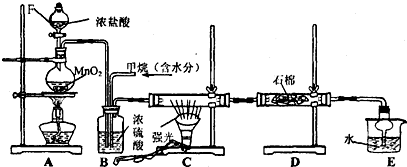
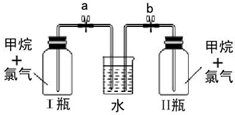
分析 (1)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱,据此分析;
(2)KMnO4与浓盐酸反应生成氯气,氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色,由此分析解答;
(3)①根据图2可知,D中Cl元素化合价为+7价,根据ClOX-中化合价代数和为-1判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,据此答题.
解答 解:(1)①Cl2、Br2、I2的颜色逐渐加深,是物理性质,无法比较非金属性强弱,故①错误;
②Cl2、Br2、I2的氧化性逐渐减弱,说明非金属性减弱,能够据此判断氯、溴、碘元素非金属性强弱,故②正确;
③HCl、HBr、HI的酸性不是最高价含氧酸,无法据此判断非金属性强弱,故③错误; ④HCl、HBr、HI的热稳定性逐渐减弱,说明非金属性减弱,能够据此判断氯、溴、碘元素非金属性强弱,故④正确;
⑤Cl2、Br2、I2和H2反应条件由光照(或点燃)→一定温度→持续加热,条件由易到难,说明非金属性减弱,能够据此判断氯、溴、碘元素非金属性强弱,故⑤正确;
⑥AgCl、AgBr、AgI的颜色逐渐加深,与非金属性强弱无关,无法据此判断氯、溴、碘元素非金属性强弱,故⑥错误;
故答案为:②④⑤;
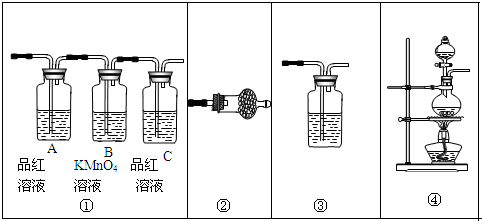
(2)KMnO4与浓盐酸反应生成氯气,氯气与淀粉碘化钾混合溶液反应生成碘单质,碘遇淀粉试液变蓝色,故C中溶液变为蓝色,氯气与淀粉碘化钾混合溶液反应离子方程式为:Cl2+2I-═2Cl-+I2,则证明了非金属性:Cl>I,所以烧瓶A中应盛放的药品是KMnO4;试管C中应盛放的药品是粉碘化钾溶液,则装置D的作用是用氢氧化钠吸收多余的氯气,防止污染环境;当观察到现象溶液变为蓝色可证明非金属性Cl>I,
故答案为:⑥;⑤;吸收未反应完的氯气,防止污染环境;C中溶液变蓝;
(3)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,
故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以生成1molClO3-时,放出117kJ的热,
故答案为:3ClO-=ClO3-+2Cl-;放出117.
点评 本题考查实验方案设计,涉及非金属性强弱的比较,反应热的有关计算等知识,题目难度中等,明确物质的性质是解本题关键,试题有利于提高学生的分析能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | BaSO4的水溶液导电性极弱:BaSO4?Ba2++SO42- | |
| B. | KHSO4在熔融状态下可导电:KHSO4=K++H++SO42+ | |
| C. | 常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O?H3O++F- | |
| D. | 向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
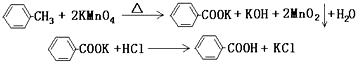
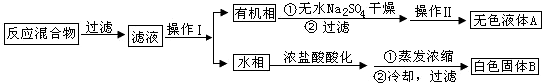
 阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 坩埚质量(g) | 坩埚和晶体的总质量(g) | 加热后坩埚和剩余固体的质量(g) |
| 11.685 | 13.691 | 12.948 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com