
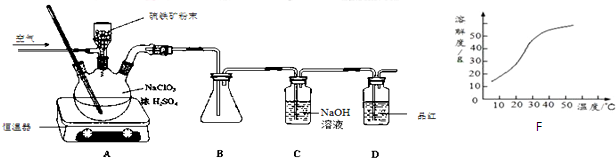
分析 (1)NaClO3与FeS2的反应中,氯从+5价变为+4价,铁从+2价变为+3价,硫从-2价变为+6价,根据化合价升降法结合电荷守恒和元素守恒配平离子方程式;
(2)ClO2熔点为-59℃,沸点为11.0℃,B中要收集ClO2,要有冰水浴;
(3)ClO2有强氧化性,能使品红褪色,通过品红可以判断ClO2是否吸收完全;
(4)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(5)①滴定时用淀粉做指示剂,溶液开始是蓝色,当滴定到终点时,溶液的蓝色会褪色;
②根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2).
解答 解:(1)NaClO3与FeS2的反应中,氯从+5价变为+4价,铁从+2价变为+3价,硫从-2价变为+6价,根据化合价升降法结合电荷守恒和元素守恒配平离子方程式为15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O,
故答案为:15;1;14;15;1;2;7;
(2)ClO2熔点为-59℃,沸点为11.0℃,B中要收集ClO2,要用冰水浴装置,
故答案为:冰水浴;
(3)ClO2有强氧化性,能使品红褪色,所以装置D的现象是红色褪去,
故答案为:红色褪去;
(4)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,防止析出晶体NaClO2•3H2O,趁热过滤,
故答案为:蒸发结晶;趁热过滤;
(5)①滴定时用淀粉做指示剂,溶液开始是蓝色,当滴定到终点时,溶液的蓝色会褪色,所以判断滴定终点的现象是加到最后一滴时,溶液的颜色突然由蓝色变为无色,且半分钟不变化,
故答案为:加到最后一滴时,溶液的颜色突然由蓝色变为无色,且半分钟不变化;
②设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{10{\;}^{-2}x×V{\;}_{1}×10{\;}^{-3}}{10{\;}^{-1}}$ 1×10-3cV2mol
x=$\frac{2cV{\;}_{2}}{{V}_{1}}$mol/L,
故答案为:$\frac{2cV{\;}_{2}}{{V}_{1}}$.
点评 本题考查物质的制备、对信息的利用、对装置的理解、氧化还原反应等,理解反应原理,掌握实验基本操作是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大,注意氧化还原反应的计算.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能与溴水反应 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 有机物分子中都存在碳碳单键 | |
| D. | 乙醇可以被氧化为乙酸,二者都能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO溶液:ClO-+H2O═HClO+OH- | B. | FeCl3溶液:Fe3++3H2O?Fe(OH)3↓+3H+ | ||
| C. | Na2S溶液:S2-+H2O?H2S+2OH- | D. | NH4Cl溶液:NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
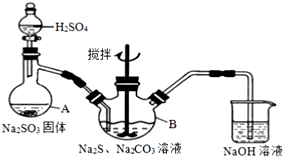 硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.
硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气溶于水:Cl2+H2O═H++Cl-+HClO | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 实验现象及数据 |
| ① | 取wgM粉末溶于过量的盐酸 | 产生气体X在标准状况下的体积为224mL,并得到无色溶液 |
| ② | 向步骤①所得的溶液中滴加氨水,调节pH至6,过滤、洗涤、灼烧、称重 | 固体Y的质量为1.020g |
| ③ | 向步骤②所得的滤液中滴加氢氧化钠溶液,调节pH至12,过滤、洗涤、灼烧、称重 | 固体Z的质量为1.200g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | Na2O2 | C. | Na2SO4 | D. | SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
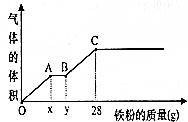 将400mL稀硫酸和稀硝酸的混合溶液平分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g铜,且反应后溶液中还有硫酸剩余;向另一份中逐渐加入铁粉,产生气体的体积和所加铁粉质量的变化关系如图所示.请回答下列问题(假设硝酸只被还原为NO气体):
将400mL稀硫酸和稀硝酸的混合溶液平分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g铜,且反应后溶液中还有硫酸剩余;向另一份中逐渐加入铁粉,产生气体的体积和所加铁粉质量的变化关系如图所示.请回答下列问题(假设硝酸只被还原为NO气体):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com