
(1)用溴乙烷合成1,2 -二溴乙烷
(2)用乙烯合成乙醚(C2H5OC2H5)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用含铝、铁、铜的合金废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4??7H2O)和胆矾晶体(CuSO4??5H2O),方案如下:
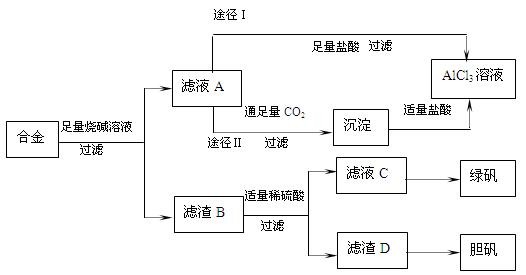
(1)写出合金溶于足量烧碱溶液时相关反应的离子方程式 ;
(2)从滤液C中得到绿矾的实验操作是蒸发浓缩、 、过滤、洗涤等。
(3)H2O2是一种应用广泛的绿色氧化剂,往滤渣D中加入稀硫酸和H2O2可以制备胆矾晶体,该反应的总化学方程式为 。
(4)由滤液A通过途径I和途径II都可得到AlCl3溶液,从产品纯度角度考虑,你认为最合理的是 (填“途径I”或“途径II”),理由是 。
(5)若上述方案所用的稀硫酸溶质质量分数为36.8%,那么100mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com