
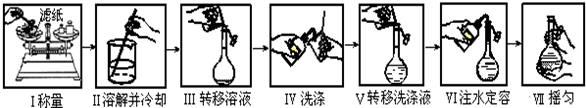
| A. | 如图是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有4步 | |
| B. | 苯的硝化实验三种溶液混合过程中,应先在试管中加入浓硝酸,再沿试管壁缓慢加入浓硫酸混合均匀,冷却到50℃以下,再在不断振荡下逐滴加入苯 | |
| C. | 1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 | |
| D. | 在试管中加入2mL硝酸银溶液,然后加入几滴NaCl溶液,再加入几滴KI溶液,可以观察到白色沉淀变成黄色沉淀,可以说明AgI的KSP小于AgCl的KSP |
分析 A.称量时NaOH应在烧杯中,转移时应利用玻璃棒引流,定容时利用胶头滴管,摇匀时盖上塞子上下颠掉;
B.混合液配制时,先加密度小的液体,再加密度大的,最后加苯;
C.碱应过量,反应在碱性条件下进行;
D.加入几滴NaCl溶液,再加入几滴KI溶液,硝酸银过量,均为沉淀的生成.
解答 解:A.称量时NaOH应在烧杯中,转移时应利用玻璃棒引流,定容时利用胶头滴管,摇匀时盖上塞子上下颠掉,则七步操作中有5步错,故A错误;
B.混合液配制时,先加密度小的液体,再加密度大的,最后加苯,则苯的硝化实验三种溶液混合过程中,应先在试管中加入浓硝酸,再沿试管壁缓慢加入浓硫酸混合均匀,冷却到50℃以下,再在不断振荡下逐滴加入苯,操作合理,故B正确;
C.1mol/L CuSO4溶液2mL和0.5mol/L NaOH溶液4mL混合后恰好反应生成氢氧化铜,碱应过量,故C错误;
D.加入几滴NaCl溶液,再加入几滴KI溶液,硝酸银过量,均为沉淀的生成,则不能比较溶度积,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及溶液配制、有机物制备、氧化还原反应及沉淀生成和转化,把握实验基本操作和化学反应原理为解答的关键,侧重实验技能及反应原理的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
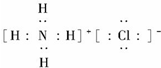 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,可以设计成原电池 | |
| B. | Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率 | |
| C. | 把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化 | |
| D. | Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
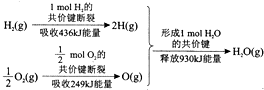
| A. | 1molH2(g)的共价键形成放出436kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1molH2(g)跟$\frac{1}{2}$molO2(g)反应生成1molH2O(g)释放能量245kJ | |
| D. | 1molH2(g)与$\frac{1}{2}$molO2(g)的总能量大于1molH2O(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O和CS2分子中的原子都达到了稳定结构.
H2O和CS2分子中的原子都达到了稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| B. | 加强碱溶液后加热,滴入酚酞试液,观察溶液颜色 | |
| C. | 加热,将湿润的红色石蕊试纸放在管口观察现象 | |
| D. | 加苛性钠溶液后加热,用湿润的红色石蕊试纸放在试管口进行检验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com